
 2,3,4-三甲基己烷,C9H20
2,3,4-三甲基己烷,C9H20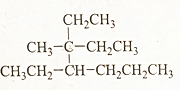 3-甲基-3,4-二乙基庚烷,C12H26.
3-甲基-3,4-二乙基庚烷,C12H26. 分析 烷烃的命名时,要选最长的碳链为主链,从离支链近的一端对主链上的碳原子进行编号,当两端离支链一样近时,要从支链多的一端进行编号,据此进行分析.
解答 解:(1)烷烃的命名时,要选最长的碳链为主链,故主链上有6个碳原子,故为己烷,从离支链近的一端对主链上的碳原子进行编号,故在2号、3号和4号碳原子上各有一个甲基,故名称为:2,3,4-三甲基己烷,分子式为C9H20,
故答案为:2,3,4-三甲基己烷;C9H20;
(2)烷烃的命名时,要选最长的碳链为主链,故主链上有7个碳原子,故为庚烷,从离支链近的一端对主链上的碳原子进行编号,故在3号碳原子上有一个甲基一个乙基,在4号碳原子上有一个乙基,故名称为3-甲基-3,4-二乙基庚烷,分子式为C12H26,
故答案为:3-甲基-3,4-二乙基庚烷;C12H26.
点评 本题考查了有机物命名,题目难度中等,注意掌握常见有机物的结构与性质,明确常见有机物的命名原则.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精灯不慎碰到起火,立马用大量水泼灭 | |
| B. | 浓碱液溅到皮肤上,用较多水冲洗,然后涂上硼酸溶液 | |
| C. | 实验结束后将剩余的K和Na不能放回原试剂瓶 | |
| D. | 加热液体的试管口能正对着自己或别人 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
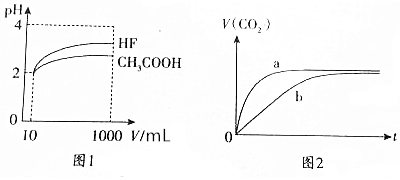
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因铝表面能行成致密的氧化膜,所以铝制餐具可以长期使用 | |
| B. | 因废弃物易污染环境,腈纶不宜大量取代棉、麻等天然材料 | |
| C. | SiO2用途广泛,因其高熔点的特性成为光导纤维的主要原料 | |
| D. | 有机玻璃(聚甲基丙烯酸甲酯)是通过缩聚反应值得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用新能源,减少化石燃料的燃烧,可防止酸雨的产生 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 建设三峡大坝使用了大量水泥,水泥是使用量最大的无机非金属材料之一 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.05 | C. | K${\;}_{a1}^{θ}$(H2S) | D. | K${\;}_{{a}_{2}}^{θ}$(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
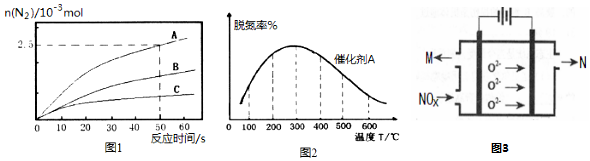
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
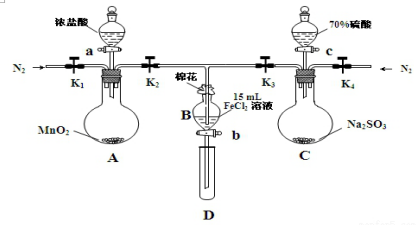
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com