

分析 (1)Ti位于周期表中第4周期,IVB族,其价电子排布式为3d24s2,据此写出价电子排布图;
(2)a.根据VSEPR理论和杂化轨道理论判断NH3分子中中心N原子的杂化方式;
b.等电子体是指原子数目相同,价电子数相同的粒子;
c.NH3分子能形成分子间氢键,导致沸点异常升高;
d.[Cu(NH3)4]2+离子是配离子,NH3为配体,配合物的形成是一方提供空轨道,一方提供孤电子对;
(3)根据VSEPR理论和杂化轨道理论判断SnBr2分子中中心原子Sn的杂化方式和SnBr2分子中的键角大小;
(4)NiO 的晶体结构与氯化钠相同,根据NaCl的晶胞知识解答.
解答 解:(1)Ti位于周期表中第4周期,IVB族,其价电子排布式为3d24s2,则在基态Ti中,价电子排布图为: ,
,
故答案为: ;
;
(2)a.对于NH3,根据VSEPR理论,中心N原子的配位原子数为3,孤电子对数为LP=$\frac{5-1×3}{2}$=1,则其价电子对数为VP=BP+LP=3+1=4,根据杂化轨道理论,中心N原子的杂化方式为sp3,故a错误;
b.等电子体是指原子数目相同,价电子数相同的粒子,NH4+与PH4+、CH4、BH4-、ClO4-的价电子数目不同,不互为等电子体,故b错误;
c.NH3分子能形成分子间氢键,导致沸点异常升高,则相同压强时,NH3的沸点比PH3的沸点高,故c正确;
d.[Cu(NH3)4]2+离子是配离子,NH3为配体,配合物的形成是一方提供空轨道,一方提供孤电子对,配体NH3中,N上有一对孤电子对,Cu2+提供空轨道,可形成配位键,故d正确,
故选cd;
(3)对于SnBr2分子,根据VSEPR理论,中心Sn原子的配位原子数目为BP=2,孤电子对数为LP=$\frac{4-1×2}{2}$=1,则其价电子对数为VP=BP+LP=2+1=3,根据杂化轨道理论,中心Sn原子为sp2杂化,理论上分子的空间构型为平面三角形,键角为120°,由于孤电子对的存在,孤电子对斥力大于键合电子对斥力,导致键角减小,<120°,
故答案为:sp2;<;
(4)NiO 的晶体结构与氯化钠相同,已知NaCl晶胞中,Na或是Cl,其配位数均为6,则NiO晶胞中Ni2+的配位数为6,
故答案为:6.
点评 本题主要考察物质结构知识,包含价电子排布图,价层电子对互斥理论,杂化轨道理论,等电子体原理,配合物的知识,氢键的性质,NaCl的晶胞结构,题目涉及的知识点较多,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取某溶液置于酒精灯火焰上灼烧,透过蓝色钴玻璃片观察火焰颜色,检验K+的存在 | |
| B. | 用玻璃棒蘸取Na2CO3溶液,滴在干燥的pH试纸上,测定该溶液的pH | |
| C. | 液溴保存时液面覆盖一层水 | |
| D. | 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作或现象 | 结论 |
| A | 向含有NaOH的Mg(OH)2悬浊液中滴加COCl2溶液,产生粉色沉淀 | KSP[CO(OH)2]<KSP[Mg(OH)2] |
| B | 将铁粉和铜粉分别和硫粉混合加热,分别生成FeS、Cu2S | 还原性:Fe>Cu |
| C | 在透明溶液中通入CO2,产生白色胶状物质 | 原溶液含有SiO32- |
| D | 控制其它条件相同,在过氧化氢中分别加入等量的氯化铁和氯化铜做催化剂,加入氯化铁的产生气泡速率更快 | 其它条件相同时,Fe3+对过氧化氢分解的催化作用强于Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下:
法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下: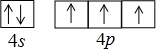
| NH3 | PH3 | AsH3 | SbH3 | |
| 熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
| 沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙二醛和足量 CH3MgBr 经 ①、②反应后的产物和乙二醇互为同系物 | |
| B. | 1molBrMgCH2CH2MgBr 和 1mol1,4-丁二醛经①、②反应后所得六元环状产物含三种氢原子 | |
| C. | 5-溴戊醛经①②反应后可得到六元环状化合物 | |
| D. | 丙酮和 CH3MgBr 经①、②反应后的产物不能发生催化氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内颜色保持不变 | B. | 2υ正(NO)=υ正(O2) | ||
| C. | 气体体积保持不变 | D. | 容器内气体密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 香豆素-4是一种激光染料,应用于可调谐染料激光器.香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示.下列有关叙述正确的是( )
香豆素-4是一种激光染料,应用于可调谐染料激光器.香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示.下列有关叙述正确的是( )| A. | ①②③ | B. | ③④⑤ | C. | ②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊变红色的溶液:K+、Fe2+、SO42-、NO3- | |
| B. | 0.1 mol•L-1NaHCO3溶液:K+、Ba2+、CO32-、Cl- | |
| C. | c(OH-)/c(H+)=l0-12的溶液:K+、Al3+、Cl-、Br- | |
| D. | 由水电离出的c(H+)=l0-12mol•L-1的溶液:Mg2+、K+、Br-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com