
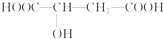 苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸是这种饮料的主要酸性物质,苹果酸的结构简式如图.下列说法正确的是( )
苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸是这种饮料的主要酸性物质,苹果酸的结构简式如图.下列说法正确的是( )| A. | 苹果酸不能使紫色石蕊试液变红 | |
| B. | 苹果酸分子间能发生酯化反应 | |
| C. | 1mol 苹果酸能与 2molNa 发生反应 | |
| D. | 1mol 苹果酸与 NaHCO3溶液反应最多消耗3mol NaHCO3 |
分析 苹果酸的分子结构中含有2个羧基和1个羟基,具有酸性,能够发生酯化反应、与Na、NaOH、NaHCO3等反应,据此分析.
解答 解:A、苹果酸的分子结构中含有2个羧基,具有酸性,能够使紫色石蕊变红,故A错误;
B、苹果酸的分子结构中含有2个羧基和1个羟基,能够发生分子间和分子内酯化反应,故B正确;
C、苹果酸的分子结构中含有2个羧基和1个羟基,1mol苹果酸能与 3molNa 发生反应,故C错误;
D、苹果酸的分子结构中含有2个羧基和1个羟基,1mol苹果酸与 NaHCO3溶液反应最多消耗2mol NaHCO3,故D错误;
故选B.
点评 本题考查有机物的 结构与性质,为高考高频考点,把握官能团与性质的关系为解答的关键,侧重醇、羧酸性质的考查,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①⑤⑦ | C. | ③④⑤⑥ | D. | ②③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH- $\stackrel{水浴加热}{→}$CH3COO--+NH4++3NH3+2Ag↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子. ,分子中有2个σ键,2个π键.
,分子中有2个σ键,2个π键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH | B. | K2CO3 | C. | ZnSO4 | D. | Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和食盐水 | B. | 0.1mol•L-1的盐酸 | ||
| C. | 0.1 mol•L-1 的CaCl2 溶液 | D. | 新制的饱和氯水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com