
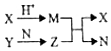
 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N>M | B. | 原子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | 图中有两个氧化还原反应 |
分析 Y为淡黄色固体,应为Na2O2,摩尔质量为78g/mol,X与Y的摩尔质量相等,且可与酸反应,则X为Na2S,且X与酸反应生成M,由转化关系可知M为H2S,N为H2O、Z为NaOH,故A为H元素、B为O元素、C为Na元素、D为S,以此解答该题.
解答 解:由以上分析可知A为H元素、B为O元素、C为Na元素、D为S,Na2S,Y为Na2O2,M为H2S,N为H2O,Z为NaOH,
A.M为H2S,N为H2O,相对分子质量M>N,由于水含有氢键,沸点较高,则沸点N>M,故A正确;
B.同主族元素从上到下原子半径逐渐增大,同周期元素从左到右原子半径逐渐减小,则原子半径应为Na>S>O>H,故B错误;
C.由以上分析可知Z为NaOH,故C错误;
D.只有过氧化钠和水的反应为氧化还原反应,故D错误.
故选A.
点评 本题考查无机物推断,为高频考点,侧重考查学生的分析能力,“物质的颜色及均由短周期元素组成”为推断突破口,基本属于猜测验证型题目,熟练掌握元素化合物性质,注意识记一些特殊的相对分子质量质量,难度较大.


科目:高中化学 来源: 题型:选择题

| A. | 金刚烷的分子式是C10H16 | |
| B. | X的一种同分异构体是芳香族化合物 | |
| C. | 上述反应都属于取代反应 | |
| D. | 金刚烷胺的一溴代物有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数a>b>c>d | |
| B. | 最高价氧化物对应水化物的碱性B>A | |
| C. | 单质还原性A>B>C>D | |
| D. | 离子半径D(n+1)->Cn->An+>B(n+1)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Al无剩余 | B. | 有白色沉淀生成 | ||
| C. | 所得气体全部为氢气 | D. | Na的物质的量是0.6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com