


科目:高中化学 来源: 题型:
| A、Cu2+、NH4+、Br-、OH- |
| B、Ag+、NO3-、Cl-、K+ |
| C、K+、Ba2+、OH-、SO42- |
| D、H+、NO3-、Fe2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氧化还原反应在生产、生活中具有广泛的用途.
氧化还原反应在生产、生活中具有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:
 2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.
2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ③ | ④ | ⑤ | |||||||||||||||
| ② | ⑥ | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-OH与OH-组成元素相同,含有的质子数也相同 |
B、NH4Cl的电子式为: |
C、丙烷分子的比例模型示意图: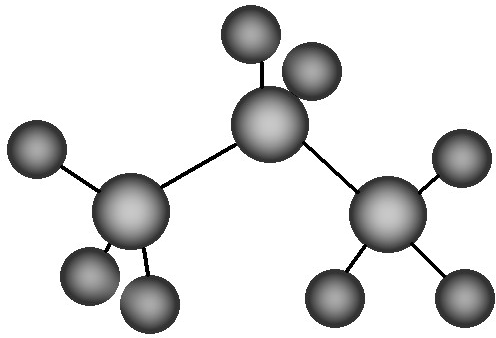 |
D、CO2分子的比例模型示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、相同条件下,pH=5的 ①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③ |
| C、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
| D、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com