
【题目】对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A. v(W)=3v(Z) B. 2v(X)=3v(Z)
C. 2v(X)=v(Y) D. 3v(W)=2v(X)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]
聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT的一种合成路线如图所示:
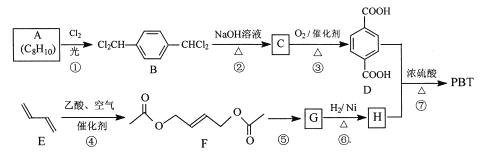
回答下列问题:
(1)A的结构简式是_________,C的化学名称是_________。
(2)⑤的反应试剂和反应条件分别是__________。
(3)F的分子式是_________,⑥的反应类型是_________。
(4)⑦的化学方程式是_________。
(5)M是H的同分异构体,同时符合_列条件的M可能的结构有_________种。
a.0.1 molM与足量金属钠反应生成氢气2.24 L(标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱显不3组峰,且峰而积之比为3:1:1的结构简式是_________。
(6)以2一甲基-1-3一丁二烯为原料(其它试剂任选),设计制备![]() 的合成路线:_________
的合成路线:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中
是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中![]() 等重金属的除去及烟气的脱硫脱硝。回答下列问题:
等重金属的除去及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸纳![]() 溶液加入亚氯酸钠
溶液加入亚氯酸钠![]() 中可制备
中可制备![]() 中
中![]() 元素的化合价是___________,该反应中氧化剂和还原剂的物质的量之比为________。
元素的化合价是___________,该反应中氧化剂和还原剂的物质的量之比为________。
(2)将![]() 通入
通入![]() 溶液,溶液中可检测到
溶液,溶液中可检测到![]() 同时有黑色
同时有黑色![]() 沉淀生成。该反应的离子方程式为:________________________
沉淀生成。该反应的离子方程式为:________________________
(3)为研究![]() 脱硝的适宜条件,在1 L 200 mg·L-1
脱硝的适宜条件,在1 L 200 mg·L-1![]() 溶液中加
溶液中加![]() 溶液调节
溶液调节![]() ,通入
,通入![]() 气体并测定
气体并测定![]() 的去除率,其关系如下图所示:
的去除率,其关系如下图所示:

①实验中使用的![]() 溶液的物质的量浓度为____________;要使
溶液的物质的量浓度为____________;要使![]() 的去除率更高,应控制的条件是__________________________。
的去除率更高,应控制的条件是__________________________。
②当溶液![]() 时,
时,![]() 的去除率增大的原因是
的去除率增大的原因是![]() 与
与![]() 溶液反应生成更强的吸收剂
溶液反应生成更强的吸收剂![]() ,写出碱性条件下
,写出碱性条件下![]() 脱除
脱除![]() 反应的离子方程式:____________
反应的离子方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )

A. 原子半径:W>Z>Y>X
B. X的氢化物于水形成的溶液呈碱性
C. 最简单气态氢化物的热稳定性:Z>W
D. Y元素的最高价氧化物的水化物不与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 凡是放热反应的发生均无需加热
B. 凡是需要加热后才能发生的反应一定是吸热反应
C. 伴有能量变化的物质变化都是化学变化
D. 物质发生化学反应都伴随着能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可发生银镜反应。A中存在化学键的类型是______;
A.离子键 B.极性键 C.非极性键 D.σ键 E.π键
B分子官能团中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体,请书写析出晶体的离子方程式___________________。
(6)e单质为面心立方晶体,其原子半径为rcm,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率的计算式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的叙述正确的是 ( )
A. 锌锰干电池工作一段时间后碳棒变细
B. 氢氧燃料电池工作时氢气在负极被氧化
C. 太阳能电池的主要材料是高纯度的二氧化硅
D. 氢氧燃料电池可将热能直接转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白黎芦醇(结构简式: )属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:
)属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:

已知:

根据以上信息回答下列问题:
(1)白黎芦醇的分子式是___________。
(2)C→D的反应类型是_______;E→F的反应类型是_________。
(3)化合物A不与FeCl3溶液发生显色反应,能与NaHCO3反应放出CO2,推测其1H核磁共振谱(H-NMR)中显示不同化学环境的氢原子个数比为________。
(4)写出A→B反应的化学方程式:___________________________________。
(5)写出结构简式:D______________、E_______________。
(6)化合物![]() 符合下列条件的所有同分异构体共_________种,
符合下列条件的所有同分异构体共_________种,
①能发生银镜反应;②含苯环且苯环上只有两种不同化学环境的氢原子。
写出其中不与碱反应的同分异构体的结构简式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可能存在的第119号元素,有人称“类钫”,据周期表结构及元素性质变化趋势,有关“类钫”的预测说法正确的是( )
A. “类钫”在化合物中呈+1价 B. “类钫”属过渡元素,具有放射性
C. “类钫”单质的密度小于1g/cm3 D. “类钫”单质有较高的熔点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com