
【题目】利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是

A. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
B. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将增大
【答案】C
【解析】
开关K置于M处,为原电池装置,X比Fe活泼可减缓铁的腐蚀;开关K置于N处,为电解池装置,Fe为阴极可减缓铁的腐蚀,结合发生的电极反应来分析解答。
A. X为碳棒,Y为NaCl溶液,开关K置于N处,形成电解池,Fe为阴极,可减缓铁的腐蚀,这种方法称为外加电流阴极保护法,故A项错误;
B. X为锌棒,Y为NaCl溶液,开关K置于M处,形成原电池,Fe为正极,可减缓铁的腐蚀,该法称为牺牲阳极的阴极保护法,故B项错误;
C. X为铜棒,Y为硫酸铜溶液,开关K置于M处,形成原电池,Fe为负极,正极上析出Cu,则铜棒质量将增加,此时外电路中的电子向铜电极移动,故C项正确;
D. X为铜棒,Y为硫酸铜溶液,开关K置于N处,形成电解池,Fe为阴极,为电镀装置,铁棒质量将增加,但溶液中铜离子浓度不变,故D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】现有反应PCl5(g)![]() PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
(1)该温度下该反应的平衡常数K为________
(2)PCl5的平衡转化率为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列结论错误的是( )
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列结论错误的是( )
A. CO与HbO2反应的平衡常数K=![]()
B. 当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
C. 人体吸入的CO越多,与血红蛋白结合的O2越少
D. 把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与水解原理无关的是
A. 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞
B. 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将两者混合就可产生大量二氧化碳的泡沫
C. 浓硫化钠溶液有臭味
D. 可用碳酸钠与醋酸制取少量二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如图:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
(1)实验操作③的名称是__,所用主要仪器名称为__。
(2)提取碘的过程中,可供选择的有机试剂是___(填编号)。选择的理由是___。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)从碘的有机溶液中得到单质碘的方法是___。
(4)步骤①灼烧海藻时,除需要三脚架外,还需要用到的实验仪器是__(从下列仪器中选出所需的仪器,将字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层电子数相同,c所在周期数与族序数相同;d与a同族,下列叙述正确的是( )
A.四种元素中b的金属性最强
B.原子半径:![]()
C.d的单质氧化性比a的单质氧化性强
D.c的最高价氧化物对应水化物是一种强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )
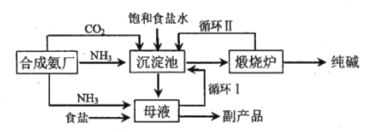
A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.25℃时,往25mL氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的一元酸HA溶液,pH变化曲线如下图所示:
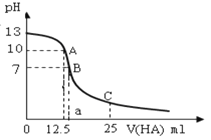
(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5mL,则所得混合溶液中由水电离出的c(OH-)=_______ mol·L-1。
(3)NaA的水溶液显______性(选填“酸”、“碱”),原因是:________(用离子方程式表示)。
(4)在B点所得混合溶液中,c(Na+) 、c(A-)、c(H+)、c(OH-)由大到小的顺序是_________。
Ⅱ.在25 ℃的条件下,某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)温度、浓度相同的CH3COOH和HClO溶液,水的电离程度前者________ 后者(填“>”“=”或“<”)。
(2)相同温度下,pH相同的NaClO和CH3COOK两种溶液中,c(CH3COOK)________c(NaClO) (填“>”“=”或“<”),[c(Na+)-c(ClO-)]_______[c(K+)-c(CH3COO-)](填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以某种软锰矿(主要成分MnO2,还有Fe2O3,Fe2O3,SiO2等)作脱硫剂,同又制得KMnO4过程如下:
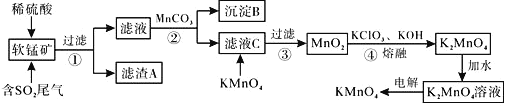
已知:Ksp[Fe(OH)3]=4×10-38,Ksp[Al(OH)3]=1×10-33。回答下列问题:
(1)滤渣A的成分是______,其中的化学键的类型是______,稳定性:SiH4 ______H2S (填“>”、“<”)。
(2)析出沉淀B时,首先析出的物质是______。试简述如何分离![]() 中的沉淀物______。
中的沉淀物______。
(3)滤液C中加入KMnO4时发生反应的离子方程式是__________。
(4)上述过程的第④、⑤、⑥步如下图所示,其中第⑥步用镍片作阳极(镍不参与反应),铁板为阴极,电解![]() 溶液可制备
溶液可制备![]() 。
。
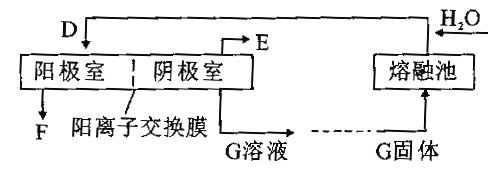
①写出熔融池中的化学方程式___________。
②则E的化学式为_________,阳极的电极反应式为__________。
③阳离子迁移方向是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com