
| A、分馏、裂化、裂解是利用化学变化来炼制加工石油的三种重要方法 |
| B、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
C、使用聚乙烯塑料制品比使用聚乳酸 (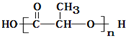 )塑料制品更环保 )塑料制品更环保 |
| D、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对环境保护、节能减排具有重要意义 |


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
| A、3:2:2 |
| B、1:2:3 |
| C、1:3:3 |
| D、3:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用此方法可以在释放出氢原子的同时获得能量 |
| B、释放出氢原子需破坏的“结合力”是非极性共价键 |
| C、氢原子比氢分子更容易燃烧,同等情况下可释放更多的能量 |
| D、常温下氯化钠的溶解度为36g,此时盐水中溶质的质量分数最大可以达到36% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X或Y均能使湿润的淀粉碘化钾试纸变蓝 |
| B、1molY或Z与足量水完全反应时,均转移1mol电子 |
| C、Z为离子化合物,但含有共价键,阴、阳离子个数比为1:2 |
| D、X和Y均能用向上排空气法和排水法收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若根据反应“H2+Cl2=2HCl”设计成燃料电池,既可发电同时还可用于制备盐酸 |
| B、氯气溶于水达到平衡后,若其他条件不变,加入少量水,水的电离平衡向正向移动 |
| C、25℃时,任何稀溶液中由水电离出的c(H+)和c(OH-)的乘积都为1×10-14 mol2?L-2 |
| D、冰醋酸中逐滴加水,则溶液的导电性先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(H CO3 -)>c(CO3 2-)>c(H2CO3) |
| C、pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、0.2 mol?L-1 CH3COOH溶液与0.1 mol?L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com