
| A. | ③④⑤⑦ | B. | ②⑤⑥⑧ | C. | ①③④⑦ | D. | ③④⑤ |
分析 ①同一元素的不同核素,质子数相同,中子数不同;
②两个非金属元素原子间以共用电子对结合;
③金属腐蚀过程中金属原子失去电子被氧化;
④因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,与化学键断裂需要的能量有关;
⑤元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强;
⑥青铜为Cu的合金、不锈钢为Fe的合金、硬铝为Al的合金;
⑦Al可与氧化铁等发生铝热反应,高温下Fe与水蒸汽反应;
⑧化学键含离子键和共价键.
解答 解:①同一元素的不同核素,质子数相同,中子数不同,则核素互为同位素,故正确;
②两个非金属元素原子间以共用电子对结合,则只能形成共价键,不能形成离子键,故正确;
③金属腐蚀过程中金属原子失去电子被氧化,即金属腐蚀的实质为金属原子失去电子被氧化的过程,故错误;
④因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,与化学键断裂需要的能量有关,N≡N键能大而稳定,非金属性N>P,故错误;
⑤元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,而氧化物对应的水化物的酸性无此规律,故错误;
⑥青铜为Cu的合金、不锈钢为Fe的合金、硬铝为Al的合金,均为合金,故正确;
⑦Al可与氧化铁等发生铝热反应,高温下Fe与水蒸汽反应,则Al和Fe在一定条件下都能与某些氧化物反应,故正确;
⑧化学键含离子键和共价键,离子相结合的作用力为离子键,原子相结合的作用力为共价键,故正确;
故选D.
点评 本题考查较综合,涉及相关概念、元素周期表和周期律的应用、化学键、元素化合物知识等,综合性较强,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于HI溶液中:Fe2O3+6H+=2Fe3++3H2O | |
| B. | [Ag(NH3)2]OH的溶液中加入盐酸:Ag++Cl-=AgCl↓ | |
| C. | Na2S2O3溶液吸收Cl2:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl- | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液:NH4++Fe2++3OH-=Fe (OH)2↓+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaF、NaCl、NaBr、NaI的熔点依次升高 | |
| B. | 熔点:铯>钾>钠>钠和钾的合金 | |
| C. | 熔沸点:HI>HBr>HCl>HF | |
| D. | 热稳定性:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | H2PO4-+H2O?HPO42-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
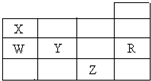
| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性高 | |
| D. | Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
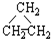 ③CH3CH2CH3 ④HC≡CCH3 ⑤
③CH3CH2CH3 ④HC≡CCH3 ⑤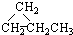 ⑥CH3CH=CHCH3.
⑥CH3CH=CHCH3.| A. | ①和② | B. | ①和③ | C. | ①和④ | D. | ④和⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| B. | 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入装有足量氯化钡溶液的洗气瓶中(如图装置),洗气瓶中产生的沉淀是硫酸钡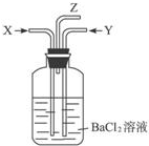 | |
| C. | 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 | |
| D. | 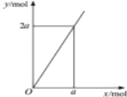 锌与不同浓度的硝酸可发生不同的反应(如图:y表示耗去Zn的物质的量,x表示被还原的硝酸的物质的量),4Zn+10HNO3(极稀)=4Zn(NO3)2+5H2O+N2O↑符合图示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com