
| A. | 硫酸钡不溶于水,所以硫酸钡不是电解质 | |
| B. | 二氧化碳溶于水可以导电,所以二氧化碳是电解质 | |
| C. | 固态磷酸是电解质,所以磷酸在熔融时和溶于水时都能导电 | |
| D. | 液态汞能导电,但汞不是电解质 |
分析 A、溶于水或熔融状态导电的化合物诶电解质;
B、电解质是本身能电离出离子的化合物;
C、磷酸是共价化合物熔融不能电离出离子;
D、汞是金属具有金属的通性,能导电,是单质.
解答 解:A、溶于水或熔融状态导电的化合物诶电解质,硫酸钡不溶于水,硫酸钡熔融状态能导电,是电解质,故A错误;
B、电解质是本身能电离出离子的化合物,二氧化碳溶于水可以导电,是二氧化碳和水反应生成了电解质碳酸,所以二氧化碳是非电解质,故B错误;
C、磷酸是共价化合物熔融不能电离出离子,不能导电,溶于水电离出离子能导电,故C错误;
D、汞是金属具有金属的通性,能导电,是单质不是电解质,故D正确;
故选D.
点评 本题考查了电解质概念的实质理解应用,主要是电解质的判断,掌握概念实质是解题关键,题目较简单.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:多选题
| A. | ①③ | B. | ④⑤ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中所用少量氯气用如图装置制取,请回答下列问题:
实验室中所用少量氯气用如图装置制取,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | X与R的核电荷数相差18 | |
| C. | 气态氢化物稳定性:W>R | |
| D. | Y与Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
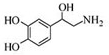
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有1个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多与2mol Br2发生取代反应 | |
| D. | 去甲肾上腺素既能与碳酸氢钠反应生成二氧化碳气体,又能与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 纯碱溶液呈碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合呈中性:2HSO4-+Ba2++2OH-═BaSO4↓+SO42-+2H2O | |
| D. | 氢氧化铜溶于氢溴酸:Cu(OH)2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com