
 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色. |
| D | 最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
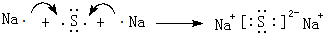 ,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-分析 X元素主要化合价为-2,原子半径为0.074nm,Z原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色,则X为氧元素、Z为硫元素;D最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子,该物质是NaOH,则D为Na元素;E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe元素;Y所在主族序数与所在周期序数之差为4,由(2)中E元素与Y元素可形成EY2和EY3两种化合物,则Y为Cl元素,据此解答.
解答 解:X元素主要化合价为-2,原子半径为0.074nm,Z原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色,则X为氧元素、Z为硫元素;D最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子,该物质是NaOH,则D为Na元素;E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe元素;Y所在主族序数与所在周期序数之差为4,由(2)中E元素与Y元素可形成EY2和EY3两种化合物,则Y为Cl元素.
(1)氧元素的一种氢化物可用于实验室制取氧气,应是过氧化氢分解生成水与氧气,其反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(2)①亚铁离子易被氧化,保存FeCl2溶液时,需向溶液中加入少量Fe单质,防止亚铁离子被氧化,故①正确;
②铁离子容易发生水解,配制FeCl3溶液时应溶解在盐酸中,故②错误;
③FeCl2可以由铁与氯化铁化合得到,FeCl3可以通过氯化钡与硫酸铁发生复分解反应得到,故③错误;
④铜片、碳棒和FeCl3溶液组成原电池,铜片为负极,电子由铜片沿导线流向碳棒,故④正确,
故答案为:①④;
(3)Na2S由钠离子与硫离子构成,用电子式表示形成过程为: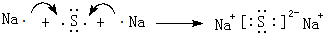 ,Na2S的水溶液中S2-离子水解:S2-+H2O?HS-+OH-,溶液呈碱性,
,Na2S的水溶液中S2-离子水解:S2-+H2O?HS-+OH-,溶液呈碱性,
故答案为: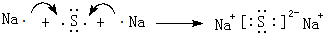 ;碱;S2-+H2O?HS-+OH-;
;碱;S2-+H2O?HS-+OH-;
(4)由题意可知,KClO3溶液在H2SO4存在下与Na2SO3溶液反应生成ClO2,根据电子转移守恒可知,SO32-被氧化为SO42-,根据元素守恒结合酸性条件下,可知还生成水,配平后离子方程式为:2ClO3-+SO32-+2H+=2ClO2+SO42-+H2O,
故答案为:2ClO3-+SO32-+2H+=2ClO2+SO42-+H2O;
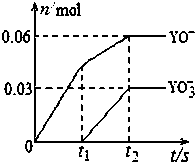
(5)Y为氯元素,将一定量氯气通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含Cl元素的离子,由图可知有ClO-、ClO3-生成,根据电子转移守恒可知还有Cl-生成,容易中n(ClO-)=0.06mol,n(ClO3-)=0.03mol,根据电子转移守恒可知生成的氯离子n(Cl-)=0.06mol+0.03mol×5=0.21mol,故转移电子物质的量为0.21mol;
根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,所以该苛性钾溶液中KOH的质量是 0.3mol×56g/mol=16.8g,
故答案为:16.8g;0.21mol.
点评 本题考查结构位置性质关系、化学用语、盐类水解、氧化还原反应及计算等,难度中等,是对学生综合能力的考查,要求学生对基础知识全面掌握,(5)中关键是根据氧化还原反应判断氯离子物质的量.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L浓H2SO4中含有0.5gH2SO4 | B. | 0.5L含有49gH2SO4的溶液 | ||
| C. | 0.5gH2SO4溶于水配成2L溶液 | D. | 0.1L含24.5gH2SO4的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于第四周期第IA族 | |
| B. | 能形成稳定的R2+离子 | |
| C. | 在化学反应中,首先失去3d上的电子 | |
| D. | 原子序数为28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
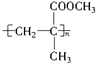 关于它的叙述不正确的是( )
关于它的叙述不正确的是( )| A. | 该有机玻璃的化学名称为聚甲基丙烯酸甲酯 | |
| B. | 该有机玻璃可用2-甲基丙烯酸和甲醇为原料,通过酯化反应、加聚反应制得 | |
| C. | 它在一定条件下发生水解反应时,可得到另外一种高分子化合物 | |
| D. | 等物质的量的有机玻璃和2-甲基丙烯酸甲酯耗氧量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.3% | B. | 15.4% | C. | 13.4% | D. | 17.0% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | As2O3中As元素为+3价 | B. | 维生素C能将+5价砷还原成As2O3 | ||
| C. | 致人中毒过程中砷发生氧化反应 | D. | 维生素C具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com