
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
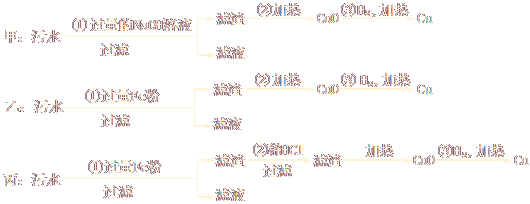
①甲、乙、丙提出的实验方案是否能得到纯净的金属铜?
甲________________,乙_____________,丙________________。(填“能”或“不能”)
②在能制得铜的方案中,哪一步操作会导致环境污染?_________________。应增加哪些措施防止污染?__________________________。
(2)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合利用:

请回答下列问题:
①在图中的括号内填写适当的反应条件。
②Mg(OH)2固体存在如下溶解平衡:
Mg(OH)2(s)![]() Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
③依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203 kg MgCl2·6H2O原料,可以获得29.8 kg MgO、________kg 36.5%的盐酸和________kg MgCl2。
查看答案和解析>>
科目:高中化学 来源:0101 会考题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com