
 如图是一个化学过程的示意图.请根据该示意图完成下列题目:
如图是一个化学过程的示意图.请根据该示意图完成下列题目:分析 (1)根据方程式及燃料电池的特点判断甲装置;根据甲装置判断乙装置;
(2)燃料电池中,负极上是燃料失电子的氧化反应,正极上是氧气得电子的还原反应;
(3)先判断电解池的电极名称,根据离子放电顺序写出相应的电解反应方程式;
(4)以惰性电极电解硝酸银,产物是硝酸、金属银和氧气;
(5)先根据得失电子数相等找出银与氧气的关系式,然后计算.
解答 解:(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;乙有外加电源,所以是电解池.
故答案为:原电池;电解池;
(2)燃料电池中,负极上是燃料失电子的氧化反应,正极上是氧气得电子的还原反应O2+2H2O+4e-=4OH-,两极反应相加得到总反应为:C2H4+2O2+4KOH=2K2CO3+2H2O;
故答案为:负极;O2+2H2O+4e-=4OH-;C2H4+2O2+4KOH=2K2CO3+2H2O;
(3)乙池中石墨电极是阳极,Fe电极是阴极,离子放电顺序为:Ag+>H+,电极反应为:Ag++e-=Ag,
故答案为:阳极;Ag++e-=Ag;
(4)乙池中,以惰性电极电解硝酸银,电解方程式为:4AgNO3+2H2O $\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:4AgNO3+2H2O $\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3;
(5)根据得失电子数相等,氧气与银的关系式为:O2~4Ag,A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2的体积是$\frac{5.4g×22.4L}{4×108g}$=0.28L=280mL,故答案为:280.
点评 原电池、电解池的判断方法:
1、若无外加电源,可能是原电池,然后再根据原电池的形成条件判定.
2、若有外接电源,两电极插入电解质溶液中,可能是电解池或电镀池,当阳极金属与电解质溶液中的金属阳离子相同时,则为电镀池.
3、若无明显外接电源的串联电路,则利用题中信息找出能自发进行氧化还原反应的装置为原电池.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
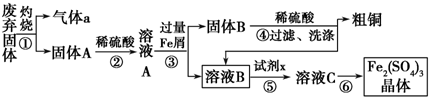
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,混合溶液中当c(H+)=$\sqrt{{k}_{W}}$ mol•L-1时可判定该溶液呈中性 | |
| B. | pH=5的H2SO4溶液,加水稀释到500倍,则稀释后c(H+)与c(SO42-)的比为2:1 | |
| C. | 某温度下,水的离子积常数Kw=10-12,该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为9:1 | |
| D. | 将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为11:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3═2Fe3++3SO42- | B. | KClO3═K++Cl-+O32- | ||
| C. | KAl(SO4)2═K++Al3++2SO42- | D. | NaHSO4═Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷在O2中燃烧的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与H2O(g)反应 | D. | 铝片与稀H2SO4反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止铁生锈,在其表面涂一层防锈油漆 | |
| B. | 为防止火灾,在面粉厂、加油站等场所要严禁烟火 | |
| C. | 为加快KClO3的分解速率,加入MnO2 | |
| D. | 为提高H2O2的分解率,向溶液中滴加FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
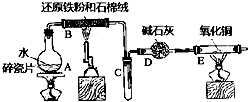 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
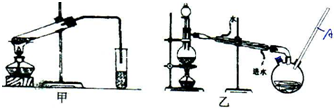
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com