
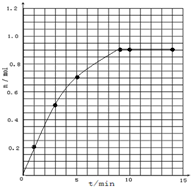
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
| △c |
| △t |
 ;
; ;
;| △c |
| △t |
| ||
| 3min |
| 1.0mol-0.55mol |
| 1.0mol |


科目:高中化学 来源: 题型:
| Q | R | ||
| T | W |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置中,A、B两池溶液的体积均为200mL,
如图装置中,A、B两池溶液的体积均为200mL,查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通常用小黑点来表示电子的多少,黑点密度大,电子数目大 |
| B、一个小黑点表示电子在该区域出现过一次 |
| C、氢原子电子云图是球形的,故与其他原子形成共价键时没有方向性 |
| D、电子云图无法绘制,通常使用的是电子云轮廓图 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应是一吸热反应 |
| B、该反应不可能是氧化还原反应 |
| C、该反应一定是氧化还原反应,同时也是一个放热反应 |
| D、该反应不一定要有氧气参加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时Zn失去电子,发生还原反应 |
| B、正极反应式为Ag2O-2e-+H2O=2Ag+2OH- |
| C、工作时负极区溶液的pH值减小 |
| D、工作时电子由Ag2O极经外电路流向Zn极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com