
| A. | 向水中加入少量固体NaHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)减小 | |
| C. | 向水中加入少量冰醋酸,平衡正向移动,c(H+) 增大 | |
| D. | 将水加热,KW增大,pH不变 |
分析 水电离生成氢离子、氢氧根离子,所以加入能电离出氢离子或氢氧根离子的物质抑制水电离,加入和氢离子或氢氧根离子反应的物质能促进水电离,温度不变,离子积常数不变,据此分析解答.
解答 解:A、向水中加入硫酸氢钠固体,硫酸氢钠电离出氢离子导致溶液中c(H+)增大,温度不变Kw不变,故A正确;
B、向水中加入氢氧化钠固体,c(OH-)增大,水的电离平衡左移,故B错误;
C、加入少量冰醋酸,溶液中的c(H+) 增大,水的电离被抑制,平衡左移,故C错误;
D、由于水的电离吸热,故将水加热,水的电离平衡右移,Kw增大,溶液中的c(H+)增大,故pH减小,故D错误.
故选A.
点评 本题考查离子积常数、水的电离,明确氢离子或氢氧根离子抑制水电离、弱离子促进水电离即可解答,注意离子积常数与溶液酸碱性无关,置于温度有关,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2用作呼吸面具的供氧剂 | B. | 工业上电解熔融状态Al2O3制备Al | ||
| C. | 工业上利用合成氨实现人工固氮 | D. | 实验室用NH4Cl 和Ca(OH)2制备NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该装置为原电池,且铜为正极 | |
| B. | 电池工作时,H+向Cu电极移动 | |
| C. | GaN电极表面的电极反应式为:2H2O-4e-═O2+4H+ | |
| D. | 反应CO2+2H2O═CH4+2O2中每消耗1mol CO2转移4mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、Mg2+、HCO3- | B. | K+、NH4+、NO3-、SO42- | ||
| C. | Al3+、K+、NO3-、HCO3- | D. | K+、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 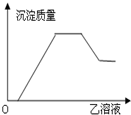 | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH | |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量排放氮氧化物可以形成酸雨、产生光化学烟雾,威胁人类生活环境 | |
| B. | 食用地沟油对人体危害大,但地沟油可用来制肥皂 | |
| C. | 明矾水解可生成Al(OH)3胶体,常用于水的杀菌消毒 | |
| D. | 人们可利用元素周期律在过渡元素中寻找性能优良的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60的摩尔质量是720 | |
| B. | 金刚石、石墨和C60互为同位素 | |
| C. | 因石墨具有导电性,可用石墨炸弹破坏输电线、电厂设备 | |
| D. | 在点燃的条件下,碳可以还原氧化镁生成镁和二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
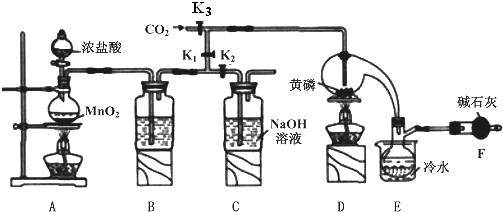
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com