

分析 A、B、C、D四种短周期元素,原子的核外电子层数:B=C=2A,则A处于第一周期,B、C处于第二周期,则A为H元素;B元素的主要化合价:最高正价+最低负价=2,B处于ⅤA族,则B为N元素;原子的最外层电子数:A+C=B+D=8,C原子最外层电子数为7,D原子最外层电子数为3,可知C为F,原子半径:A<C<B<D,则D为Al,据此解答.
解答 解:A、B、C、D四种短周期元素,原子的核外电子层数:B=C=2A,则A处于第一周期,B、C处于第二周期,则A为H元素;B元素的主要化合价:最高正价+最低负价=2,B处于ⅤA族,则B为N元素;原子的最外层电子数:A+C=B+D=8,C原子最外层电子数为7,D原子最外层电子数为3,可知C为F,原子半径:A<C<B<D,则D为Al.
(1)A和B组成的最简单分子为NH3,电子式为 ,故答案为:
,故答案为: ;
;
(2)元素C为F元素,在周期表中位置为:第二周期ⅦA族,故答案为:二;ⅦA;
(3)元素C的钠盐为NaF,溶液中存在平衡:F-+H2O=HF+OH-,破坏水的电离平衡,溶液呈碱性,
故答案为:碱;F-+H2O=HF+OH-.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生对知识的迁移应用与分析解决问题的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用水溶解后过滤分离 | B. | 用稀盐酸溶解过滤分离 | ||
| C. | 用稀硫酸溶解过滤分离 | D. | 用酒精灯加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
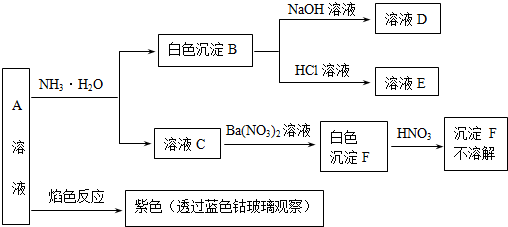
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4-在反应中失去5mol电子 | ||
| C. | 从反应中看出草酸性质很不稳定 | D. | 配平该反应后,H+的计量数是6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 等体积等物质的量浓度的NaCl和NaClO溶液中离子总数:N前<N后 | |
| C. | 1mol/L的(NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) | |
| D. | 0.1mol/LNaHX溶液pH=3,则此溶液中有:c(HX-)>c(H2X)>c(X2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
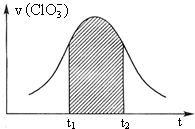 KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )
KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )| A. | 开始时反应速率增大可能是由c(H+)增大所致 | |
| B. | 纵座标为v(H+)的v-t曲线与右图曲线完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 阴影部分面积可以表示t1-t2时间内c(Cl-)增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 55 kJ | B. | 220 kJ | C. | 550 kJ | D. | 1 108 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下的溶解度:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | |
| C. | 表示Na2CO3和NaHCO3分别与Ba(OH)2溶液反应的离子方程式相同 | |
| D. | 等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com