
����Ŀ��ij����С��������CuO��NH3��Ӧ���о�NH3��ij�����ʲ��ⶨ����ɣ����������ʵ��װ�ã��г�װ��δ����������ʵ�顣��ش��������⣺
��1�� ����a������Ϊ________������b�п�ѡ����Լ�Ϊ________��
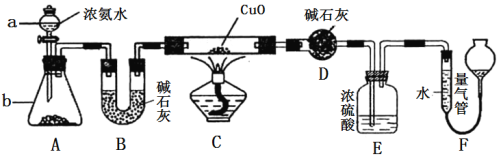
��2��ʵ�������������и������ʣ�������Ȫʵ�飬���ܳɹ����� ��
A.Cl2�뱥��ʳ��ˮ B.CO2 ��40%��NaOH��Һ
C.NH3�뱥��ʳ��ˮ D.HCl��ˮ
��3��ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�����壬��������֤��NH3����________�ԣ�д����Ӧ�Ļ�ѧ����ʽ ��
��4��Eװ����Ũ���������________________________________��
��5��ʵ����ϣ�����ø����D����mg��װ��F�����������ΪnL(�������ɱ�״�����������е������ԭ�Ӹ�����Ϊ________(�ú�m��n��ĸ�Ĵ���ʽ��ʾ)��
���𰸡���1����Һ©�� (1��) �����ƻ��������ƻ��ʯ�� (1��)
��2��A (1��)
��3����ԭ (1��) 3CuO + 2NH3![]() 3Cu + N2�� + 3H2O (2��)
3Cu + N2�� + 3H2O (2��)
��4������δ��Ӧ�İ�������ֹF��ˮ��������D (2��) ��5��![]() (2��)
(2��)
��������
�����������1�����������Ľṹ�ص��֪��װ��������aΪ��Һ©��������b�����÷�Һ©���е���İ�ˮʹ��ƿ�еĹ����ܽ���ȴٽ�һˮ�ϰ��ֽ����ɰ���������Ҫ��Ĺ���������������ƹ��塢�����ƹ��塢��ʯ�ҹ���ȡ�
��2������������Һ�巴Ӧ��Ѹ���ܽ�ʱ�������ƿ�ڲ�ѹǿ��С��������ƿ�������ѹǿ����γ���Ȫ��A��Cl2�ڱ���ʳ��ˮ�е��ܽ�Ⱥ�С�����Բ����γ���Ȫʵ�飬A�������⣻B��CO2 �ܱ�40%��NaOH��Һ���գ���������ƿ�ڲ�ѹǿ��С�������γ���Ȫ��B���������⣻C��NH3��������ˮ�������뱥��ʳ��ˮ�����γ���Ȫ��C���������⣻D. HCl��������ˮ������ˮ�γ���Ȫ��D���������⣬��ѡA��
��3��ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�����壬˵������������ͭ��Ӧ����ͭ�͵�����ˮ������������ͭ�������ֻ�ԭ�ԣ�������ӵ�ʧ�غ��ԭ���غ���ƽд���Ļ�ѧ����ʽΪ3CuO + 2NH3![]() 3Cu + N2�� + 3H2O��
3Cu + N2�� + 3H2O��
��4���������̷����������ǹ����ģ�����Ũ���������չ����İ�����ͬʱ����ֹF��ˮ��������DӰ��ʵ��Ч����
��5�����D����ˮ��������������ø����D����mg����ˮ���ʵ�����![]() mol��װ��F�����������ΪnL��������ɱ�״����ΪN2�����������ʵ�����
mol��װ��F�����������ΪnL��������ɱ�״����ΪN2�����������ʵ�����![]() mol����������ԭ���غ�õ���ԭ�Ӻ���ԭ�����ʵ���֮����
mol����������ԭ���غ�õ���ԭ�Ӻ���ԭ�����ʵ���֮����![]() mol ��2:
mol ��2: ![]() mol��2��
mol��2��![]() ����������е������ԭ�Ӹ�����Ϊ
����������е������ԭ�Ӹ�����Ϊ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.1 mol/L��K2CO3��Һ����μ���0.1 mol/L��ϡ����40 mL,��Һ�к�̼Ԫ�صĸ�����(CO2���ݳ�δ����)�����ʵ�����������ҺpH�仯���������ͼ��ʾ������˵����ȷ����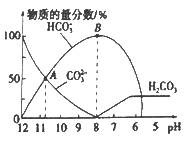
A.����ϡ����ļ��룬��Һ�� ![]() ���ֲ���
���ֲ���
B.����A����㣬Ka2 (H2CO3)��������Ϊ10-3
C.B ����������Һ�У�c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D.��pHԼΪ8ʱ����Һ�п�ʼ�ų�CO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������������ǵ�����������ʡ�
��1���γ������ԭ��֮һ�ɼ�ʾ��ͼ��

��ش��������⣺
�������pH_____�����������������=����5.6��
��D���ʵĻ�ѧʽΪ_____��
�۷�Ӧb�Ļ�ѧ����ʽΪ_____��
��2����һ�������°��������������������ת��Ϊ����Ⱦ�����ʣ�д�������Ͷ���������һ�������·�Ӧ���ɵ�����ˮ�Ļ�ѧ����ʽ��____________________����Ӧ����������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A~J�dz����Ļ�ѧ���ʣ�ת����ϵ����ͼ��ʾ��A�������е�һ�ֵ�ζ����I��һ����;�㷺�Ľ�����������C��D��E��F��J��Ϊ���壬 H������Ԫ�ع��ɣ�Ħ������Ϊ41 g��mol��1��

��1��I�Ļ�ѧʽΪ________,H�Ļ�ѧʽΪ________��
��2��д����Ӧ�٢ڢۢܵĻ�ѧ����ʽ
��_______����________�� ��_______�� ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���о���ѧ��ӦA+B�TC+D�������仯�����ijͬѧ�������ͼ��ʾװ�ã�����ʢ��A���Թ��еμ��Լ�Bʱ������U�ι��м״�Һ���½��Ҵ�Һ���������Իش��������⣺

��1���÷�ӦΪ __________ ��Ӧ��������������������������
��2��A��B����������C��D�������� __________ ����������������������
��3�������еĻ�ѧ��ͨ����ѧ��Ӧת���� ________________ �ͷų�����
��4����Ӧ�ﻯѧ���������յ����� ______ ���������������������������ﻯѧ���γɷų���������
��5��д��һ���������������Ļ�ѧ����ʽ�� ________________________________________________________________________________
������֪��P4�����ף�s��+5O2��g���TP4O10��s����H=-2 983.2kJmol-1��
P�����ף�s��+![]() O2��g���T
O2��g���T![]() P4O10��s����H=-738.5kJmol-1 ��
P4O10��s����H=-738.5kJmol-1 ��
�����ת��Ϊ�����Ȼ�ѧ����ʽΪ _________________________________________ ����ͬ״���£�����״̬�ϵ͵��� __________ �������ȶ��ԱȺ��� ______ ����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��е���������Ԫ�أ���д���пհף�
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A |
2 | �� | �� | �� | �� | |||
3 | �� | �� | �� | �� |
��1��������������ˮ�����У�������ǿ�Ļ������������______��������ǿ�Ļ��������ѧʽ��_______��
��2���ݢ��γɻ�����ĵ���ʽ___�����γɵ����������Ľṹʽ____��
��3������������������������Ԫ����Ԫ�ط�����____��д������������������������������ˮ���ﷴӦ�����ӷ���ʽ________��
��4�����ĵ�������������������ˮ���ﷴӦ�����ӷ���ʽ��______��
��5�����������γ�ԭ����1��2��Һ̬������ף������ܽ����ĵ��ʣ��õ���ʽ��ʾ���γɹ��̣�____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����Ũ������ͭ��Ӧ��ʵ������У��۲쵽ͭƬ�����ڣ����ǶԺ�ɫ���ʵ���ɽ���ʵ��̽����
��1��������ͼ��ʾװ�ý���ʵ��1�������Ⱥͼг���������ȥ��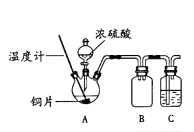
ʵ��1��ͭƬ��Ũ���ᷴӦ
���� | ���� |
���ȵ�120��~250�� | ͭƬ�����ڣ��д�������������γ�ī��ɫ��Һ |
����������338�� | ͭƬ�Ϻ�ɫ��ʧ��ƿ�г��֡�����������Һ�Դ���ɫ��ƿ�ײ��н϶�Ұ�ɫ���� |
��װ��B����������װ��C��ʢ�ŵ��Լ�����
��Ϊ֤��Aװ���лҰ�ɫ��������Ҫ�ɷ�Ϊ����ͭ��ʵ���������������
��2��̽��ʵ��1��120��~250��ʱ���ú�ɫ����ijɷ֡�
��������롿��ɫ�����п��ܺ���CuO��CuS��Cu2S�е�һ�ֻ��֡�
���������ϡ�
����1�������軯��[K4Fe(CN��6]��Cu2+����������������Cu2+����Һ�еμ������軯����Һ�����ɺ���ɫ������
����2��
CuS | Cu2S |
��ɫ�ᾧ���ĩ | �Һ�ɫ�ᾧ���ĩ |
������ϡ����������������Ũ��ˮ���ȵ�Ũ���� | ������ϡ�����Ũ����������������Ũ��ˮ |
����Ʋ�ʵʩʵ�顿
ʵ��2.̽����ɫ�������Ƿ�CuO
���� | ���� |
i.ȡ���渽�ź�ɫ�����ͭƬ5Ƭ������ˮϴ�ɾ�������ʢ��10mL�Լ�A��С�ձ��У����� | ��ɫ�������䣬¶��������ͭƬ |
ii.ȡ��ͭƬ������ɫ�������� | �ϲ���Һ���塢��ɫ |
���Լ�A����
�ڼ���Ϊii����Һ��ɫ�п�����Cu2+Ũ��̫С�����Dz���ʵ��ȷ������Һ�в���Cu2+ �� �����ʵ���������������
ʵ��3.̽����ɫ�������Ƿ�CuS��Cu2S
���� | ���� |
i.ȡʵ��2�к�ɫ������������������Ũ��ˮ������ | �й���ʣ�࣬��Һ�ֽ��߸�������Һ��dz��ɫ |
ii.��ȡʵ��2�к�ɫ������������������Ũ���ᣬ�Ⱥ��� | �й���ʣ�࣬��Һ���dz��ɫ |
����ý��ۡ���ʵ��2��ʵ��3�ɵõ��Ľ����ǣ�ʵ��1�У�120��~250��ʱ���ú�ɫ��������
��ʵ�鷴˼��
����ʵ��1��338��ʱ���������ԭ��ͬѧ����Ϊ�ǽϵ��¶�ʱ�����ĺ�ɫ�������ȵ�Ũ�����һ����Ӧ��ɡ���֪��Ӧ�ĺ���������ˮ����ͭ��ж����������ɫ������ʧʱ���ܷ��������з�Ӧ�Ļ�ѧ����ʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧһ������������ԭ��Ӧ���ǣ� ��
A.���Ϸ�Ӧ
B.�û���Ӧ
C.�ֽⷴӦ
D.���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��830Kʱ�����ܱ������з������п��淴Ӧ��CO��g��+H2O��g��CO2��g��+H2��g����H��0������ʼʱc��CO��=2molL��1 �� c��H2O��=3molL��1 �� �ﵽƽ��ʱCO��ת����Ϊ60%�����ڴ��¶��£��÷�Ӧ��ƽ�ⳣ��K= ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com