
分析 (1)NO2和N2O4的混合气体中O元素质量分数为$\frac{32}{46}$,计算氧元素质量,再根据n=$\frac{m}{M}$计算氧原子物质的量;
根据n=cV计算硝酸铁物质的量,硝酸根物质的量为硝酸铁的3倍,再根据N=nNA计算硝酸根数目;
(2)①反应中只有N元素化合价变化,由+3价升高为HNO3中+5价,降低为NO中+2价,则NO的系数为2、HNO3系数为1,NF3的系数为3,结合原子守恒配平书写方程式;根据N元素化合价变化计算转移电子;
②氧化剂氧化性强于氧化产物氧化性;
(3)次氯酸钠与氨气反应生成N2H4,反应中N元素化合价升高,NH3为还原剂,则NaClO为氧化剂,反应中还原剂与氧化剂的物质的量之比为2:1,设Cl元素在还原产物中化合价为a,则2×[(-2)-(-3)]=1×(1-a),解得a=-1,故还原生成NaCl,由元素守恒可知有水生成.
解答 解:(1)NO2和N2O4的混合气体中O元素质量分数为$\frac{32}{46}$,氧元素质量为69g×$\frac{32}{46}$=48g,氧原子物质的量为$\frac{48g}{16g/mol}$=3mol;
溶液中硝酸铁物质的量为2L×0.6mol/L=1.2mol,硝酸根物质的量为1.2mol×3=3.6mol,NO3-离子数目为3.6NA个,
故答案为:3;3.6;
(2)①反应中只有N元素化合价变化,由+3价升高为HNO3中+5价,降低为NO中+2价,则NO的系数为2、HNO3系数为1,NF3的系数为3,结合原子守恒,可得化学方程式为:3NF3+5H2O=2NO+HNO3+9HF,若反应中生成0.2mol HNO3,转移的电子数目=0.2mol×2×NAmol-1=0.4NA,
故答案为:3NF3+5H2O=2NO+HNO3+9HF;0.4NA;
②3NF3+5H2O=2NO+HNO3+9HF中氧化剂为NF3,NO为还原产物,氧化性NF3>NO,4NH3+3F2=NF3+3NH4F中氧化剂为F2,氧化产物为NF3,氧化性F2>NF3>NO,
故答案为:F2>NF3>NO;
(3)次氯酸钠与氨气反应生成N2H4,反应中N元素化合价升高,NH3为还原剂,则NaClO为氧化剂,反应中还原剂与氧化剂的物质的量之比为2:1,设Cl元素在还原产物中化合价为a,则2×[(-2)-(-3)]=1×(1-a),解得a=-1,故还原生成NaCl,由元素守恒可知有水生成,反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O,
故答案为:NaClO+2NH3=N2H4+NaCl+H2O.
点评 本题考查氧化还原反应,涉及氧化还原反应计算、配平、氧化性比较等,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意题目给予信息的运用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | Na2SO3溶液中:c(H+)+c(HSO3-)+c(H2SO3)═c(OH-) | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 向含有AgCl固体的溶液中加入适量水使AgCl溶解又达到平衡时,在该温度下AgCl的溶度积不变,其溶解度也不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )
在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )| A. | 该反应的化学平衡常数表达式为K=c4(H2O)/c4(H2) | |
| B. | 5min时该反应的υ(正)等于9min时的υ(逆) | |
| C. | 0~5min内,υ(H2)=0.10mol/(L•min) | |
| D. | 10min时平衡发生移动可能是投入还原性铁粉引起 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 称为“现代有机合成之父”的伍德沃德曾组织14个国家的110位化学家,协同攻关,探索维生素B12的结构,其结构如图对此结构的下列说法中,正确的是( )
称为“现代有机合成之父”的伍德沃德曾组织14个国家的110位化学家,协同攻关,探索维生素B12的结构,其结构如图对此结构的下列说法中,正确的是( )| A. | 维生素B12属于有机物 | B. | 维生素B12属于无机物 | ||
| C. | 维生素B12属于烃 | D. | 维生素B12属于芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X分子中最多可有9个碳原子共平面 | |
| B. | X可以发生取代、加成、聚合等反应 | |
| C. | 1 mol X与足量NaHCO3溶液反应所得物质的分子式为C9H7O4Na | |
| D. | 苯环上的取代基与X完全相同的X的同分异构体有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe的质量为2.7g,Al的质量为2.8g | B. | Fe的质量为2.8g,Al的质量为2.7g | ||
| C. | Fe的质量为5.4g,Al的质量为5.6g | D. | Fe的质量为5.6g,Al的质量为5.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
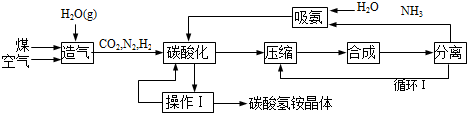

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,是原电池的装置图,请回答:
如图所示,是原电池的装置图,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com