
| A. | 根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体 | |
| B. | SiO2既能与NaOH溶液反应,又能与氢氟酸反应,但SiO2不属于两性氧化物 | |
| C. | AgCl的水溶液不易导电,故AgCl是弱电解质 | |
| D. | 烧碱、纯碱、熟石灰均属于碱 |
科目:高中化学 来源: 题型:解答题
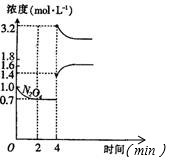
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将四份溶液稀释相同倍数后,溶液的pH:③>④>①>② | |
| B. | 将①、④等体积混合,则混合液的PH为7 | |
| C. | 四份溶液中水的电离程度由大到小的顺序为:③>①=②=④ | |
| D. | 将②加入③至恰好完全反应,则消耗体积为③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 实验室制大量CO2 | 向石灰石中加入稀硫酸 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 配制0.1mol/L CuSO4溶液 | 把2.5g胆矾晶体溶于水配成100mL溶液 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com