
已知A、B、C、D、E、F、G为前四周期七种元素且原子序数依次增大,其中A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C原子核外成对电子数比未成对电子数多1个,其氢化物常用作致冷剂,D原子未成对电子与周期数相同,在E元素所在周期中的基态该原子的第一电离能最小;F原子价电子nsn-lnpn+l;G单质是硬度最大的金属。
请回答下列问题:
(1)G元素基态原子价电子排布式为??????????????????????? 。
(2)B、C、D三种元素的最简单氢化物的键角由小到大的顺序为____?????? (填元素符号),常温下硬度最大的B单质、E2F、H2D及H2F的沸点由大到小的顺序为____??? (填化学式)
(3)D元素与氟元素相比,电负性:D?????????? 氟元素(填“>”、“=”或“<”),?? 下列表述中能证明这一事实的是????????????? (填选项序号)-
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)离子化合物CA5的晶体中含有多种化学键:但一定不含有的化学键是????????? (填选项序号)。
A.极性键?????? B.非极性键?????? C.配位键?????? D.金属键
(5)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为____???? ;1molB2A4分子中含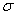 键???????? mol。
键???????? mol。
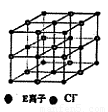
(6)如图是E的氯化物的晶胞示意图,最近两个E离子之间距离为a cm,则该晶体密度为?????????? (已知阿伏加德罗常数为NA).
(1)3d54s1
(2)O、N、C??? C、Na2S 、H2O、 H2S
(3)<? B、C
(4)B、D
(5)sp2杂化 ;?? 5
(6)
【解析】
试题分析:根据题意可推出这几种元素分别是:A是H;B是C;C是N;D是O;E是Na;F是S;G 是Cr。(1)Cr元素基态原子价电子排布式为 3d54s1? 。2)甲烷的键角为109°28′;NH3的键角为键角为107°18′;H2O的键角为104.3°。所以它们键角由小到大的顺序为O、N、C。常温下硬度最大的C单质金刚石属于原子晶体;Na2S属于离子晶体;H2O及H2S都属于分子晶体。一般情况下沸点的高低顺序是:原子晶体>离子晶体>分子晶体。由于在H2O之间存在氢键,增加了分子之间的相互作用,所以沸点H2O>H2S。故沸点由大到小的顺序为C> Na2S > H2O > H2S 。(3)元素的非金属性越强,其电负性就越大。由于非金属性F>O。所以电负性F>O。(4)离子化合物NH5可表示为NH4H.在其晶体中含有的化学键包括离子键、极性共价键、配位键。不含有非极性键和金属键。因此选项为B、D。(5)在C2H4中C原子轨道的杂化类型为sp2杂化。1mol C2H4分子中含 键有4和C—H键和一个C—C键共5个。(6)在每个晶胞中含有的Na+个数为:8×1/8+6×1/2=4;含有的Cl-的个数为:12×1/4+1=4。即每个晶胞中含有4个NaCl。最近两个Na+在面对角线的位置的一半,设晶胞的边长为L.其离子之间距离为a cm。
键有4和C—H键和一个C—C键共5个。(6)在每个晶胞中含有的Na+个数为:8×1/8+6×1/2=4;含有的Cl-的个数为:12×1/4+1=4。即每个晶胞中含有4个NaCl。最近两个Na+在面对角线的位置的一半,设晶胞的边长为L.其离子之间距离为a cm。 。所以
。所以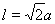 。该晶体密度为
。该晶体密度为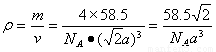 g/cm3.
g/cm3.
考点:考查元素的推断、元素的价电子排布式的书写、电负性的比较、元素的氢化物、晶体的沸点的比较、晶体中的化学键类型及密度的计算的知识。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
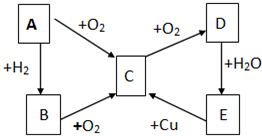 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com