
��ѧ���ѧ����ᡢ�����ͻ���������ء������й�˵���д������
A��Ŀǰ��ѧ�����Ƶõ�ԭ�Ӳ��࣬�����Ǩ�����ǹ��10������������������ܼ����оƬ
B��2014�������ǹ��ұ����˰��������飬�����������Ի�ѧҩƷ���У��Ҵ�������������Һ�����Խ������������ﵽ������Ŀ��
C��CO2��CH4�����ȴ����ȶ����������ЧӦ����˶����ڴ�����Ⱦ��
D����ɫ��ѧ�������û�ѧԭ����Դͷ������Ⱦ�������������г������ԭ�ϣ�ʵ�����ŷ�
 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016��㶫ʡ�����и�����ѧ�ڵڶ��ε��в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��M��N�Ƕ�������ԭ�������������������Ԫ�ء���֪X�������������ǵ��Ӳ�����3����X��Mͬ���壬Y��ԭ���ڶ���������Ԫ����ԭ�Ӱ뾶��������й�˵����ȷ����
A�� M��N�ļ����Ӱ뾶�� r��N-����r��M2����
B�� ��̬�⻯����ȶ��ԣ�M��X
C�� X��Y�γɵĻ�������ֻ�����Ӽ�
D�� X��Y��N���γɻ������ˮ��Һ���������Ի����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ������ѧ�ڵڶ���ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ�ڹ�ҵ�������ճ�������������Ҫ��Ӧ�á�����˵����ȷ����
A��CO2��NO2��SiO2����������������Ǵ�����Ⱦ��
B��Na2O2��H2O2������ѧ����ȫ��ͬ��������������
C�������£�Ũ���ᡢŨ�����������ܷ����ۻ���������������
D��NaClO��������������������ˮ���������̪��Һ���Ժ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�Ͼ�����У������ѧ��12��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ�����ʾ��ȷ����
A��������Ϊ53��������Ϊ78�ĵ�ԭ�ӣ�
B��N2�ĵ���ʽ��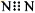
C��S2-�Ľṹʾ��ͼ��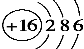
D����ȩ�Ľṹ��ʽ��CH3CH2COH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
Al��Fe��Cu������Ҫ�������Ľ����������й�˵����ȷ����
A�����ߵĵ����ڳ����¶�������Ũ�����Ũ����
B�����ߵĵ��ʷ����ڿ����о�ֻ����������
C����������Ӧ������������ˮ�ж������ܽ�ƽ��
D����ҵ���Ʊ������ֽ����ķ�������Ϊ��ⷨ���ȷֽⷨ���Ȼ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ϻ���ʮ��У������ѧ�ڵ�һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�к���NH4+��Mg2+��Fe2+��Al3+��SO42���������ӣ��������м������������������Һ���Ȳ����裬�ټ������������ᣬ��Һ�д������ٵ�������
A��4�� B��3�� C��2�� D��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���Ĵ�ʡ�Թ��и����ϵ�һ����Ͽ������ۻ�ѧ�Ծ��������棩 ���ͣ������
��X��Z��W���ֺ�14�����ӵ����ӣ���ṹ�ص����£�
���Ӵ��� | X | Z | W |
ԭ�Ӻ���Ŀ | ���� | ͬԪ�ع��ɵ����� | ͬԪ�ع��ɵ����� |
���ӵĵ��� | ������ | ��������� | ������ |
��1��X�������ᄃ���к��л�ѧ��������_____________��
��2��Z���������ɵĻ�����ĵ���ʽΪ_____________��
��3�����W��Ԫ�صļ��⻯�K������ˮ����Ҫԭ���� �����⻯����������Թ���һ��ȼ�ϵ�أ�����Ϊ�����ʣ��������Һ��KOH��Һ���为���ĵ缫��ӦʽΪ____ ���ڳ����£��øõ�ص��1.5 L 1mol/LNaCl��Һ�������ı�״����1.12LW�ļ��Ȼ���ʱ��NaCl��Һ��pH=
(�������������Һ���������)��
��4��Mԭ�Ӻ����Xԭ�Ӷ�2�����ӡ����淴Ӧ2MO2(��)+O2(��)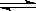 2MO3(��)�������ܱ������н��У�A��������һ���������ƶ��Ļ�����B�����ɱ��ֺ���(��ͼ��ʾ)������A��B�зֱ����1molO2��2mol MO2��ʹ�������V(A)=V(B)������ͬ�¶��·�Ӧ����ƽ������ʱ�䣺t(A)___________t (B)(�>������<������=��������ȷ��������ͬ)��ƽ��ʱMO2��ת���ʣ�a(A)_____________a(B)��
2MO3(��)�������ܱ������н��У�A��������һ���������ƶ��Ļ�����B�����ɱ��ֺ���(��ͼ��ʾ)������A��B�зֱ����1molO2��2mol MO2��ʹ�������V(A)=V(B)������ͬ�¶��·�Ӧ����ƽ������ʱ�䣺t(A)___________t (B)(�>������<������=��������ȷ��������ͬ)��ƽ��ʱMO2��ת���ʣ�a(A)_____________a(B)��
��5�����Ƚ�X��M��Ԫ�صķǽ��������ǿ�����ɲ�ȡ�Ĵ�ʩ�� (�����)��

a���Ƚ�������Ԫ�ص���̬�⻯��ķе�
b���Ƚ�������Ԫ�صĵ����ڳ����µ�״̬
c���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
d���Ƚ�������Ԫ�صĵ������������ϵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�갲��ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ȼ�ѧ����ʽ�����ӷ���ʽ�У���ȷ����
A���Ȼ�þ��Һ�백ˮ��Ӧ��Mg2+ + 2OH�� �� Mg(OH)2 ��
B��500�桢30MPa�£���0��5molN2��1��5mol H2�����ܱ������г�ַ�Ӧ����NH3(g)������19��3kJ�����Ȼ�ѧ����ʽΪ��
N2(g) + 3H2(g)  2NH3(g) ��H= -38��6kJ��mol-1
2NH3(g) ��H= -38��6kJ��mol-1
C������ı�ȼ���ȡ�H= -890��3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
CH4(g) + 2O2(g) �� CO2(g)��2H2O(g) ��H= -890��3kJ��mol-1
D������������NaOH��Һ��Al2O3 + 2OH�� ��2AlO2�� + H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������е���У������ѧ������������ѧ�Ծ��������棩 ���ͣ������
X��Y��Z��W��L��M���ֶ���������Ԫ�ص�ԭ������������������X��M�ĵ����ڳ����³���̬��Y��ԭ������������������Ӳ�����2����Z��ͬ���ڵ�����Ԫ����ԭ�Ӱ뾶���W�ǵؿ��к������Ľ���Ԫ�أ�L�ĵ��ʾ����۵�ߡ�Ӳ�ȴ���һ����Ҫ�İ뵼����ϣ��û�ѧ����ش��������⣺
��1��M�����ӽṹʾ��ͼ ��L��Ԫ�����ڱ��е�λ��Ϊ ��
��2��Y��L��M����ۺ����������������ǿ��˳���� ��
��3��Y�����������ĵ���ʽΪ ��ԭ��������Y��2��Ԫ�ص�һ���⻯���ֽܷ�Ϊ������һ���⻯��˷ֽⷴӦ�Ļ�ѧ����ʽ�� ��
��4��Z��W���Ե�����������Ӧ��ˮ������Է�Ӧ�����κ�ˮ���÷�Ӧ�����ӷ���ʽΪ ��
��5��R��Yͬ���ڣ�R�ĵ��ʷ���R2����3�����ۼ���R��X�γɻ�����ף�1mol��18mol���ӣ���д���Ľṹʽ ��
��6��������������������ף������ɵ�����һ���⻯����⻯�����Է�������Ϊ43�����е�ԭ�ӵ���������Ϊ97.7%�����⻯��ķ���ʽΪ �����⻯����ײ��ʱ��ȫ�ֽ�Ϊ��������������2.15g���⻯����ײ��������������ڱ���µ����Ϊ L��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com