
下列实验现象或描述正确的是( )
A. 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
B. 铜在氯气中燃烧生成蓝色烟
C. 二氧化硅不与任何酸反应,可用石英制造耐酸容器
D. 明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
用下图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
| ①中的物质 | ②中的物质 | 预测①的现象 |
| |
| A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 | |
| B | 酚酞溶液 | 浓盐酸 | 无明显变化 | |
| C | AlCl3溶液 | 浓氨水 | 有白色沉淀 | |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列的各种说法中,正确的是
A.12C的相对原子质量为12g·mol-1
B.MgCl2的摩尔质量是95 g
C.0.5 mol氢元素约含6.02×1023个氢原子
D. 32g O2和O3的混合物中,共有2mol氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程图如下所示,下列说法错误的是:
盐卤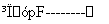 Mg(OH)2
Mg(OH)2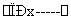 MgCl2溶液
MgCl2溶液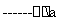 MgCl2•.6H2O
MgCl2•.6H2O 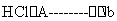 MgCl2
MgCl2 Mg
Mg
A.若在实验室进行操作①,只需要漏斗和烧杯两种玻璃仪器
B.操作①发生的反应为非氧化还原反应
C.操作②是蒸发浓缩结晶
D.在整个制备过程中,未发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
为维持人体血液中的血糖含量,在给
|
院病人输液使用的一瓶质量分数为6%的葡萄
糖(C6H12O6)注射液标签,请认真观察标签
上所列内容后计算:
(1)该溶液的物质的量浓度为 mol·L-1(精确到0.1g)。
(2)该溶液的密度为 g·mL-1(精确到0.1g)。
(3)如果从该瓶中取出75g葡萄糖注射液,将其变为15%的注射液,需要加入 ______g
葡萄糖固体(精确到0.1g)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项操作中发生先沉淀后溶解现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO2 ④向石灰水中通入过量CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸
A. ①②④ B.②③⑤ C.②④ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.碳酸氢镁溶液加入过量氢氧化钠:
B.碳酸钡溶于醋酸溶液:
C.次氯酸钙溶液中通入少量二氧化碳: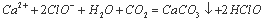
D.氧化铁加入氢碘酸中: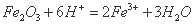
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
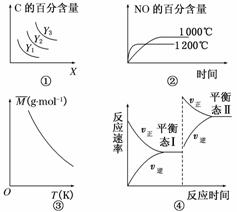
A.对于A(s)+2B(g)3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y1>Y2>Y3
B.已知可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
C.已知反应2A(g)B(?)+2C(?)-Q(Q>0),满足如图③所示的关系,则B、C可能 均为气体
D.图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A===H++HA-,HA-H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 B.小于7
C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
Ⅱ.含有Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
Cr2O
 Cr3+、Fe3+
Cr3+、Fe3+ Cr(OH3)、Fe(OH)3
Cr(OH3)、Fe(OH)3
(1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。
(2)若处理后的废水中残留的c(Fe3+) =2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com