
��֪��25��ʱ��FeS��CuS���ܶȻ�����(Ksp)�ֱ�Ϊ6.3��10��18��1.3��10��36������ʱ�����й�˵����ȷ����
A����H2S�ı�����Һ��ͨ������SO2������Һ��������ǿ
B����������CuSO4�ܽ���0.1 mol/L��H2S��Һ�У���Һ��Cu2�������Ũ��Ϊ
1.3��10��35 mol/L
C����ΪH2SO4��ǿ�ᣬ���Է�Ӧ��CuSO4��H2S===CuS����H2SO4���ܷ���
D����ȥ��ҵ��ˮ�е�Cu2������ѡ��FeS��������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
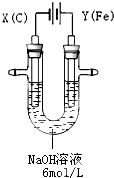 ������أ�K2FeO4�����и�Ч���������ã�Ϊһ�����ͷ��ȸ�Ч����������ⷨ�Ʊ�������ز�����㣬�ɹ��ʸߣ�����ʵ�����Ʊ�����ԭ����ͼ��ʾ��
������أ�K2FeO4�����и�Ч���������ã�Ϊһ�����ͷ��ȸ�Ч����������ⷨ�Ʊ�������ز�����㣬�ɹ��ʸߣ�����ʵ�����Ʊ�����ԭ����ͼ��ʾ��| ��� | �ŵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
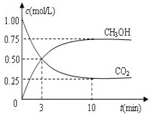 2009��10��15���»��籨����ȫ��ũ��Ӧ���ڡ���ɫ��̬-�������-��̼����-ѭ����չ�������������£�������õط�չ���й���ɫ��ׯ�������롰��̫���ʵ�̼ũׯ�����裮�ɼ�����̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺
2009��10��15���»��籨����ȫ��ũ��Ӧ���ڡ���ɫ��̬-�������-��̼����-ѭ����չ�������������£�������õط�չ���й���ɫ��ׯ�������롰��̫���ʵ�̼ũׯ�����裮�ɼ�����̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺| c(CH3OH) | c(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| ��������/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
| �ŵ� |
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
- 3 |
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| ��������/% | 88 | 92 | 93 | 95 | 95 | 95 | 93 | 90 | 87 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ��ɽ�и�����ѧ������⣨�������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
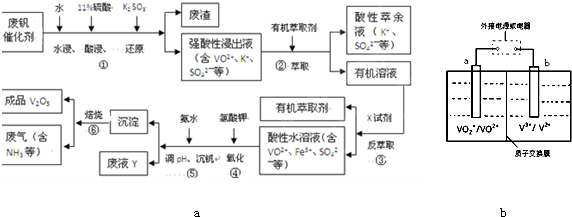
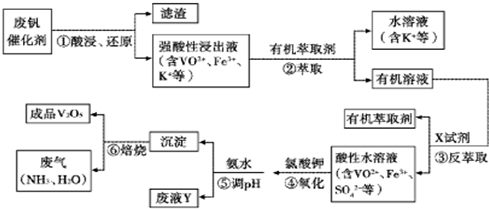
��ҵ����ƽ�VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5���������£�
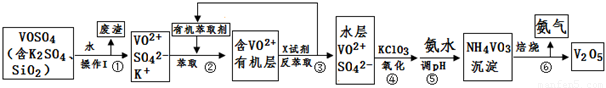
��ش��������⣺
��1����������÷����ijɷ��� ��д��ѧʽ��������I������ ��
��2������ڡ��۵ı仯���̿ɼ�Ϊ����ʽR��ʾVO2+��HA��ʾ�л���ȡ������
R2(SO4)n (ˮ��)+ 2nHA���л��㣩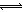 2RAn���л��㣩 + nH2SO4 (ˮ��)
2RAn���л��㣩 + nH2SO4 (ˮ��)
������ȡʱ��������������ԭ���� ��
����X�Լ�Ϊ ��
��3���ݵ����ӷ���ʽΪ ��
��4��25��ʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
|
pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
|
��������% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
����ϱ�����ʵ�������У����м��백ˮ��������Һ�����pHΪ ������������Ϊ93.1%ʱ������Fe(OH)3����������Һ��c(Fe3+)< ������֪��25��ʱ��Ksp[Fe(OH)3]=2.6��10��39��
��5���ù��������У�����ѭ�����õ������� �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com