
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 | |
| C. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 | |
| D. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
分析 A.酸性条件下,NaClO能把Br-氧化为溴单质;
B.某消毒液的主要成分为NaClO,还会含有NaCl,能与Ag+反应生成氯化银沉淀;
C.根据ClO-+Cl-+2H+═Cl2+H2O计算;
D.NaClO溶液显碱性,离子方程式中不能有氢离子.
解答 解:A.酸性条件下,NaClO能把Br-氧化为溴单质,所以在该溶液中Br-不能大量共存,故A错误;
B.某消毒液的主要成分为NaClO,还会含有NaCl,能与Ag+反应生成氯化银沉淀,所以该溶液中Ag+不能大量共存,故B错误;
C.向该溶液中加入浓盐酸,发生反应为ClO-+Cl-+2H+═Cl2+H2O,每产生1molCl2,转移电子为1mol,即转移电子约为6.02×1023个,故C正确;
D.NaClO溶液显碱性,离子方程式中不能有氢离子,向该溶液中滴入少量FeSO4溶液,该离子反应为3ClO-+6Fe2++3H2O=2Fe(OH)3↓+3Cl-+4Fe3+,故D错误.
故选C.
点评 本题考查了氧化还原反应和离子共存问题,题目难度不大,注意把握强氧化性物质与还原性物质能发生氧化还原反应所以不能共存.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.595g | B. | 1.42g | C. | 2.485g | D. | 2.72g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
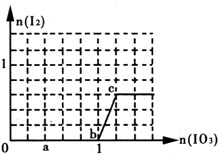
| A. | a点时消耗NaHSO3的物质的量为1.2 mol,得到的氧化产物为SO42- | |
| B. | b~c段的反应可用如下离子方程式表示:IO3-+5 I-+6H+═3I2+3H2O | |
| C. | 滴加过程中水的电离平衡一直逆向移动 | |
| D. | 从c点后所得混合液中分离出碘的操作为:加四氯化碳萃取分液,然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X分别和其他四种元素均可形成至少2种化合物 | |
| B. | M、W、X、Y、Z的原子半径由大到小的顺序为Y>Z>X>W>M | |
| C. | X气态氢化物的稳定性大于Z态氢化物,但是X气态氢化物的沸点小于Z气态氢化物 | |
| D. | M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的电离 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
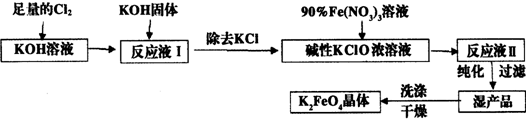
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用潮汐发电是将化学能转化为电能 | |
| B. | 蒸馏法淡化海水的过程中一定发生了化学变化 | |
| C. | 从海水中可以获得MgCl2,电解熔融MgCl2可制备Mg | |
| D. | 可以用分液的方法将海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯可用作制食品包装袋的原料 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| D. | 含硫燃料燃烧产生的二氧化硫是形成酸雨的罪魁祸首 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入饱和Na2CO3溶液中 | B. | SO2通入CaCl2溶液中 | ||
| C. | NH3通入HNO3和AgNO3的混和溶液中 | D. | SO2通入Na2S溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com