
【题目】向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )。
A.Ba2+(aq)+SO![]() (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO![]() (aq)===BaSO4(s) ΔH=-18 kJ·mol-1
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1
C.Ba2+(aq)+SO![]() (aq)===BaSO4(s) ΔH=-73 kJ·mol-1[来源
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1[来源
D.Ba2+(aq)+SO![]() (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
【答案】B
【解析】
试题分析:100mL 0.4molL-1 Ba(OH)2的物质的量为0.04mol,向H2SO4溶液中加入100mL 0.4molL-1 Ba(OH)2溶液反应涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+OH-(aq)=H2O(l),100mL 0.4molL-1 HCl的物质的量为0.04mol,反应涉及的离子方程式为H+(aq)+OH-(aq)=H2O(l),根据放出的热量为2.2kJ,可知H+(aq)+OH-(aq)=H2O(l)△H=-![]() =-55kJmol-1,设Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-QkJmol-1,则0.04Q+0.08mol×55kJmol-1=5.12kJ,解之得Q=18,所以Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJmol-1。故选B。
=-55kJmol-1,设Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-QkJmol-1,则0.04Q+0.08mol×55kJmol-1=5.12kJ,解之得Q=18,所以Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJmol-1。故选B。


科目:高中化学 来源: 题型:
【题目】“神舟七号”的燃料是氢化锂三兄弟——LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是
A. 质子数之比为1:2:3 B. 中子数之比为1:1:1
C. 摩尔质量之比为8:9:10 D. 化学性质不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组依据反应AsO43-+2H++2I-![]() AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响,测得输出电压与pH的关系如图。下列有关叙述错误的是
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响,测得输出电压与pH的关系如图。下列有关叙述错误的是
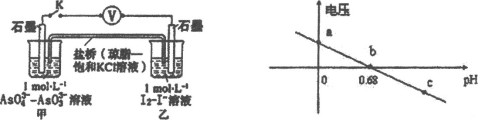
A.c点时,正极的电极反应为ASO43-+2H++2e-=AsO33-+H2O
B.b点时,反应处于化学平衡状态
C.a点时,盐桥中K+向左移动
D.pH>0.68时,氧化性I2>AsO43-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
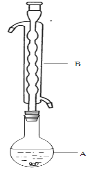
④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________________。其作用是___________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)大小烧杯间填满碎泡沫塑料的作用是_______________。
(2)_________(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。其原因是__________________。
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是________(填“偏高”“偏低”或“无影响”)。
(4)如果改用60mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_______(填“增加” “减少”或“不变”),理由是_____________;所求中和热数值_________(填“增加”“减少”或“不变”),理由是_______________;
(5)________(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是______________________.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度/t2/℃ | 温差(t2-t1)/ ℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.184×10—3kJ/(g·℃),则该反应的中和热为△H=____________(保留小数点后一位)。
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_______(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电子云及示意图的说法正确的是( )
A. 电子云是笼罩在原子核外的云雾
B. 小黑点多的区域表示电子多
C. 小黑点疏的区域表示电子出现的机会少
D. 电子云是用高速照相机拍摄的照片
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com