
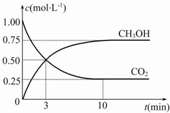
 (1)在95℃时,纯水的pH
(1)在95℃时,纯水的pH

科目:高中化学 来源: 题型:
| A、石墨转化成金刚石是自发进行的过程 |
| B、金刚石转化石墨是非自发进行的过程 |
| C、相同质量时,石墨比金刚石能量低 |
| D、相同质量时,金刚石比石墨能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌锰干电池工作一段时间后碳棒变细 |
| B、氢氧燃料电池可将热能直接转化为电能,是环境友好型电池 |
| C、铅蓄电池是一次电池,对环境有污染 |
| D、乙醇不能做锂电池内部的电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
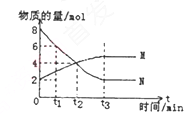
| A、t3时,反应达到最大限度 |
| B、t2,正、逆反应速率相等,达到平衡 |
| C、反应的化学方程式:N?2M |
| D、t1时N的浓度是M浓度的4倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
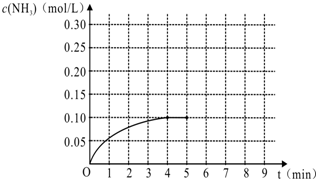
科目:高中化学 来源: 题型:
| T/K | T1 | 573 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
| ||
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | △H1 |
| CO(g) | △H2 |
| CH4(g) | △H3 |
| ||
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(B) |
| c(C) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com