
科目:高中化学 来源: 题型:选择题
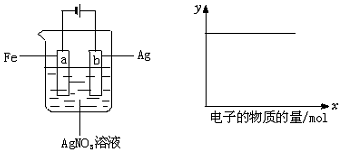
| A. | (1)(2) | B. | (3)(4) | C. | (1)(2)(4) | D. | (1)(2)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
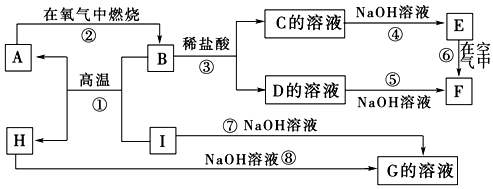
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn与稀H2SO4反应:2Zn+2H+═2Zn2++H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | 硫酸氢钠溶液与过量氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
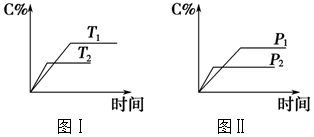
 己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )| A. | a代表20℃下A的Y-t曲线 | |
| B. | 反应到66min时,0℃和20℃下反应放出的热量相等 | |
| C. | 0℃和20℃下达到平衡时,反应都放出QkJ热量 | |
| D. | 反应都达到平衡后,正反应速率a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 9g | C. | 12g | D. | 13.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题:
实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学方程式中m+n<e+f | |
| B. | 达平衡后,若升温,平衡左移 | |
| C. | 达平衡后,加入催化剂则C%增大 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
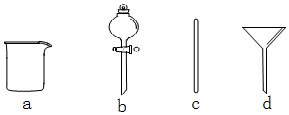
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com