

| A. | 12.10mL | B. | 12.00mL | C. | 11.90mL | D. | 11.80mL |
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
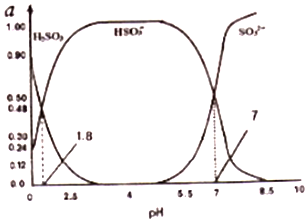
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
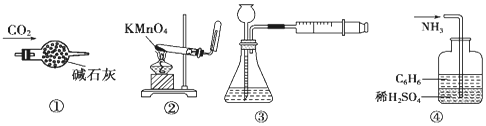
| A. | 装置①:干燥CO2 | B. | 装置②:实验室制取并收集O2 | ||
| C. | 装置③:装置气密性的检查 | D. | 装置④:吸收NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内各物质X、Y、Z的浓度之比为1:1:2 | |
| D. | 单位时间内消耗0.1 molX,同时生成0.2 molZ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
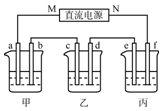 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5%的NaOH溶液、足量的CuSO4溶液和10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3- | B. | S2-、AlO2- | C. | Al3+、Fe3+ | D. | MnO4-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,用秸秆可制得葡萄糖和酒精 | |
| B. | 铁制品表面涂“银粉”(铝粉)防生锈,是由于铝的化学性质比铁的稳定 | |
| C. | 氧气被用作火箭的燃料,利用了氧气的可燃性 | |
| D. | 稀有气体充入霓虹灯,利用了稀有气体通电时发出不同颜色的光的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com