
| ||
| 1.12L |
| 22.4L/mol |
| 1.12L |
| 22.4L/mol |
| ||
| ||
| ||
| 4mol×1.12L |
| 22.4L |
| 0.2mol |
| 0.2L |


科目:高中化学 来源: 题型:
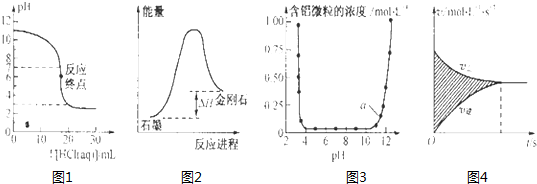
| A、图1表示0.001mol?L-1盐酸滴定0.001mol?L-1NaOH溶液的滴定曲线 |
| B、图2所示,从能量角度考虑,石墨比金刚石稳定 |
| C、图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存Al3+ |
| D、图4所示,图中的阴影部分面积的含义是[v(正)-v (逆)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在用蒸馏水洗涤烧杯时,洗涤液未全部注入容量瓶中 |
| B、定容摇匀后,发现液面低于刻度线,又加水到刻度线 |
| C、定容时俯视刻度线 |
| D、用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH>7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B、0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D、已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2溶于水可以导电,说明SO2是电解质 |
| B、电解质本身可以导电,也可以不导电 |
| C、强电解质与弱电解质的差别就是溶液导电性不同 |
| D、物质的量浓度相同的NaOH溶液与氨水,氨水的pH值较小,说明氨水是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
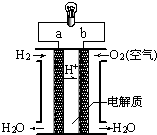
| A、a极是负极 |
| B、正极的电极反应是:O2+2H2O+4e-═4OH- |
| C、电子由a通过灯泡流向b |
| D、氢氧燃料电池是环保电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量是可以把物质的质量与微观粒子数联系起来的一个基本物理量 |
| B、摩尔是国际单位制中七个基本物理量之一 |
| C、1mol任何微观粒子的质量以克为单位,数值上等于该粒子的相对原子(分子)质量 |
| D、含有6.02×1023个粒子的任何微观粒子集体计量为1摩尔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com