
| A. | 煤、石油、天然气均为化石燃料,它们属于可再生资源 | |
| B. | 生物质能来源于植物及其加工产品所贮存的能量 | |
| C. | 氢气的燃烧产物是水,不会污染环境,是理想的清洁燃料 | |
| D. | 大自然利用太阳能最成功的是植物的光合作用 |
分析 A、化石燃料不能再生;
B、生物质能就是太阳能以化学能形式贮存在生物质中的能量形式,即以生物质为载体的能量.它直接或间接地来源于绿色植物的光合作用;
C、氢气是理想的燃料;
D、根据光合作用是利用太阳能进行分析.
解答 解:A、化石燃料包括煤、石油和天然气,是由远古时代的动植物转化而来,故不能再生,故A错误;
B、生物质能就是太阳能以化学能形式贮存在生物质中的能量形式,即以生物质为载体的能量.它直接或间接地来源于绿色植物的光合作用,所以生物质能来源于植物及其加工产品所贮存的能量,故B正确;
C、氢气燃烧后生成水,且氢气是可再生能源,故是理想的燃料,故C正确;
D、太阳能应用最成功的是植物的光合作用,故D正确;
故选A.
点评 本题考查了化学与生产和生活,明确可持续发展的含义是解题关键,注意氢气运输、储存不方便,题目难度不大.


科目:高中化学 来源: 题型:解答题
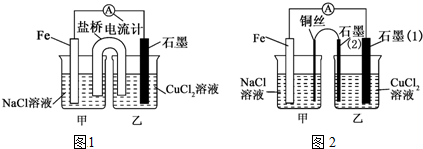
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中离子浓度关系为:c (Na+)>c(HCO3-)>c (OH-)>c(H+) | |
| B. | 25℃时,加水稀释后,$\frac{c(O{H}^{-})}{c({H}^{+})}$变小 | |
| C. | 温度升高,c(OH-)×c(H+)不变(忽略体积变化) | |
| D. | 溶液中c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
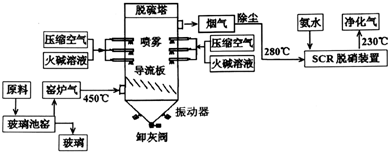
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH试纸 | B. | 紫色石蕊试液 | C. | Na2CO3固体 | D. | CuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘单质的升华过程中,只需克服分子间作用力 | |
| B. | NH4Cl属于离子化合物,该物质中只存在离子键 | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | 金刚石和足球烯(C60)均为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
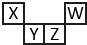 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )| A. | 最高正化合价:X<Y<Z | |
| B. | 原子半径:X<Y<Z | |
| C. | 气态氢化物的热稳定性:Z<W | |
| D. | 最高价氧化物对应水化物的酸性:X<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
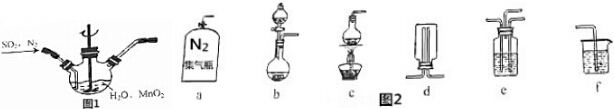
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与CO2反应 | D. | NaOH与HCl反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com