
| A. | CuSO4 | B. | Fe2(SO4)3 | C. | 稀HNO3 | D. | Al2(SO4)3 |
分析 铁片能溶解,说明铁能够与溶液发生反应,若不反应,则溶液的质量保持不变,然后再看反应后,生成的溶质的质量是否增大或减小,从而判断出溶液的质量的变化.
解答 解:A.铁与CuSO4反应后,生成FeSO4溶液,每消耗1mol铁则生成1mol铜,溶液的质量减少,故A正确;
B.铁与硫酸铁反应生成硫酸亚铁,没有沉淀生成,溶液质量增加,故B错误;
C.铁与稀硝酸反应生成硝酸铁和一氧化氮,消耗1mol铁生成1molNO,溶液质量增加,故C错误;
D.铁的活泼性弱于铝,铁与硫酸铝不反应,溶液质量不变,故D错误;
故选:A.
点评 本题考查金属铁的化学性质,熟悉金属活泼性,明确发生反应实质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$ (g)+3H2(g)△H
(g)+3H2(g)△H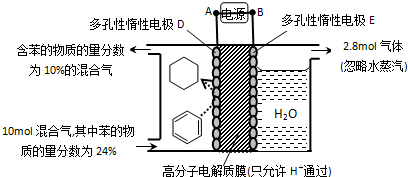
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①装置可验证酸性:H2CO3>H2SiO3 | |
| B. | 图②装置可用于收集气体H2 CO2 Cl2 NH3 | |
| C. | 图③装置可用于分离CCl4萃取碘水后的有机层和水层 | |
| D. | 图④装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定有甲烷 | B. | 一定有乙烷 | ||
| C. | 可能是甲烷和乙烷的混合物 | D. | 可能是乙烷和丙烷的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素符号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径10-1nm | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5-3 | +7-1 | +1 | +5-3 | +3 |
| A. | 元素④的原子序数小于元素⑦的原子序数 | |
| B. | ②、③处于同一周期 | |
| C. | 上述八种元素中.最高价氧化物对应水化合物酸性最强的元素是⑤ | |
| D. | ⑧号元素原子结构示意图为: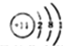 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
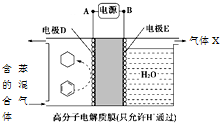
| A. | A为电源的正极 | |
| B. | 气体X是H2 | |
| C. | 电极E为阴极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com