
【题目】下列说法正确的是( )
A. 生石灰能与水反应,可用于实验室干燥氯气
B. NO2、、SO2二种气体都能与水反应生成酸,它们都是酸性氧化物
C. SO2、NOx的大量排放会导致酸雨的发生
D. 高温下,二氧化硅与碳酸钠反应放出CO2,可说明硅酸的酸性比碳酸强
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】同一周期的X、Y、Z三种主族元素,已知其最高价氧化物对应水化物的化学式分别为H2XO3、H3YO4、H2ZO4,下列说法正确的是
A. 气态氢化物的稳定性:XH4>YH3>H2Z;
B. 元素非金属性强弱关系:X>Y>Z
C. 最高价氧化物对应水化物酸性:H2XO3>H3YO4>H2ZO4
D. 原子半径:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是
A. 用少量水稀释0.1 mol/L氨水时,溶液中![]() 减小
减小
B. 将Na2CO3溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 0.1 mol/L Na2CO3与0.1 mol/L NaHCO3溶液等体积混合:
3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D. 0.1 mol/L的NaOH溶液和0.2mol/L的NH4Cl溶液等体积混合后:
c(OH-)-c(H+)=c(Na+)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________(填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:___________________________。
(2)图2中,钢闸门C作________极。若用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为_____________________________________,检测该电极反应产物的方法是_________________________________________。

(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的________极(填“正”或“负”)。F电极上的电极反应式为_______________________________________________________________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因:___________________________________________________。
(4)乙醛酸(![]() )是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为_____________________________________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的性质及结构信息如下:
① 原子半径A>B>C>D>E;
② 五种元素之间形成的常见的四种分子如下:
甲 | 乙 | 丙 | 丁 | |
比例模型 |
|
|
|
|
组成元素 | D、E | B、E | A、D、E | C、E |
电子总数 | 10 | 18 | 26 | 10 |
请根据上述信息回答下列问题:
(1)A元素的单质与物质甲发生反应的离子方程式为__________,其化学反应平衡常数的表达式为_______。
(2)戊与乙互为同系物,有五种同分异构体,戊的分子式为_____,己与乙具有相同的电子数,与甲含有的元素种类相同,己分子的结构式为_______。
(3)C与E元素组成的CE3与液氮可组成燃料电池,产物均为无污染的物质,可用于驱动潜艇,燃料电池装置如下图所示。该电池的负极反应式为_____。电池工作时OH-向_____移动(填“正极”或“负极”)。
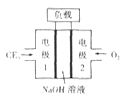
(4)B与D组成的一种物质在自然界中可循环,循环时其与CaCO3反应。已知Ksp(CaCO3)=2.8×10-9,现将CaCl2溶液与Na2CO3溶液等体积混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀的最小浓度为__________(忽略混合前后溶液的体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、NO、NH3是中学中常见的几种气体。
(1)质量之比为32:7:30的三种气体SO2、CO、NO,分子数之比为_______,氧原子数之比为_______。
(2)标准状况下,4.25g NH3的体积为______L,它与标准状况下_____L H2S含有相同数目的氢原子。
(3)将标准状况下6.72L SO2通入1L 0.6mol/L NaOH溶液中,左后得到的溶质是______,该溶质的物质的量浓度为________mol/L(忽略通入气体后溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:
(1)分别写出三只烧杯中形成分散系的名称:
A________,B________,C________。
(2)写出C中形成分散系的化学方程式:_____________________________________。
(3)若不用化学试剂鉴别,写出鉴别B、C分散系的两种简单方法:
①______________________________________________________,
②________________________________________________________。
(4)向C中逐滴加入稀H2SO4,现象为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A. 若管道漏气遇氨就会产生白烟
B. 该反应利用了Cl2的强氧化性
C. 该反应中HCl是氧化产物
D. 生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的O2和O3的质量比为___________。
(2)2.5 mol Ba(OH)2中含有__________个OH-,2.5 mol Ba(OH)2的质量是___________g。
(3)在标准状况下,1.7 g氨气所占的体积约为___________L,它与标准状况_________L硫化氢含有相同数目的氢原子。
(4)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为_____________。
(5)同温同压下,SO2与氦气的密度之比为___________,若质量相同,两种气体的体积比为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com