
【题目】下列物质在所述变化中,既发生离子键破坏,又发生共价键破坏的是( )
A.干冰升华
B.烧碱融化
C.HCl气体溶于水
D.NH4Cl受热分解
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱的饮料,由于含有Fe2+,现榨的苹果汁会由淡绿色变为棕黄色,在这种苹果汁中加入维生素C,可避免该现象,这些现象体现了( )
A.Fe2+具有酸性,维生素C具有碱性
B.Fe2+具有还原性,维生素C也具有还原性
C.Fe2+具有氧化性,维生素C具有还原性
D.Fe2+具有碱性,维生素C具有酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.30![]()
![]() 、0.10
、0.10![]()
![]() 和一定量的
和一定量的![]() 三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示[
三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示[![]() 阶段的
阶段的![]() 变化未画出]。乙图为
变化未画出]。乙图为![]() 时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,
时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同, ![]() 阶段为使用催化剂。下列说法不正确的是
阶段为使用催化剂。下列说法不正确的是
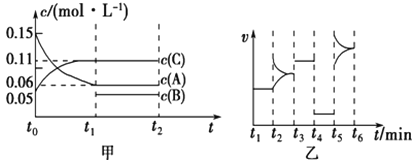
A. 若![]() ,则用
,则用![]() 的浓度变化表示的
的浓度变化表示的![]() 阶段的平均反应速率为0.004
阶段的平均反应速率为0.004![]()
B. ![]() 阶段改变的条件一定为减小压强
阶段改变的条件一定为减小压强
C. 若该容器的容积为2![]() ,则
,则![]() 的起始的物质的量为0.02
的起始的物质的量为0.02![]()
D. 若![]() 阶段,容器内
阶段,容器内![]() 的物质的量减少了0.03
的物质的量减少了0.03![]() ,而此过程中容器与外界的热交换总量为
,而此过程中容器与外界的热交换总量为![]() ,则该反应的热化学方程式为:
,则该反应的热化学方程式为: ![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类社会的发展进程中,金属起着重要的作用.下列说法正确的是( )
A.地球上绝大多数金属元素是以游离态存在于自然界中的
B.在化学反应中,金属容易失去电子,是还原剂
C.多数合金的熔点高于组成它的成分的金属的熔点
D.硅单质是良好的半导体,所以它是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏碘滴定法可测量中药材中二氧化硫是否超标(亚硫酸盐折算成二氧化硫)。原理是利用如图装置将亚硫酸盐转化为SO2,然后通过碘标准溶液滴定吸收液。

实验步骤如下:
I.SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300 mL; 锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液; 打开冷凝水,通氮气,滴入盐酸10mL; 加热烧瓶A并保持微沸约3min后,用0.01000mol/L 碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL;
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL.
(1)仪器C的名称______。仪器B的入水口为_______(填“a”或“b”)。
(2)滴入盐酸前先通氮气一段时间作用是________,测定过程中氮气的流速过快会导致测量结果______。(填“偏大”“偏小”“不变”)
(3)①滴定过程中使用的滴定管为_________。
A.酸式无色滴定管 B.酸式棕色滴定管 C.碱式无色滴定管 D.碱式棕色滴定管
②滴定时锥形瓶中反应的离子方程式为________,滴定终点的现象是________。
(4)空白实验的目的是________。
(5)该中药中含SO2含量为________mg/ kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M
①氧化剂是H3AsO3;②还原性:Cl->As;
③每生成7.5gAs,还原剂失去的电子为0.3 mol;
④M为OH-;⑤ SnCl62-是氧化产物。
关于该反应的说法中正确的组合是( )
A.①③⑤
B.①③
C.①②④⑤
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从溶液中获取固体溶质,常见的方法是蒸发,一般有以下操作过程:①放置蒸发皿;②固定铁圈位置;③放置酒精灯;④停止加热,余热蒸干;⑤加热搅拌。其正确的操作顺序为( )
A.①③②④⑤B.①②③④⑤C.②③①⑤④D.③②①⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述中,正确的是( )
A.CCl4分子的球棍模型: ![]()
B.![]() 所有碳原子可能在同一平面上
所有碳原子可能在同一平面上
C.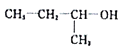 命名为2-甲基-1-丙醇
命名为2-甲基-1-丙醇
D.乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】和硅同一主族的锗也是重要的半导体材料,锗应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:

已知:①“碱浸”过程中的反应为:GeO2+2NaOH=Na2GeO3+H2O、As2O3+2NaOH=2NaAsO2+H2O
② GeCl4的熔点为-49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃。
(1)砷的原子序数为33,砷在元素周期表中的位置为第______周期第________族。
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,其反应的离子方程式为:___________________________________________________________________。
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是_________________。
(4)“蒸馏”过程中的反应的化学方程式为:________________________________。
(5)“水解”操作时保持较低温度有利于提高产率,其最可能的原因是_____________(答一条即可)。
(6)若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的较纯二氧化锗产品,则杂质脱除率为_________。
(7)和砷同一主族的锑也可以用于半导体中。一种突破传统电池设计理念的镁—锑液态金属二次电池工作原理如图所示:

该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,C1-向______(填“上”或“下”)移动;放电时,正极的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com