
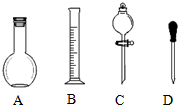
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器,判断缺少的仪器;
(2)容量瓶是一种精密仪器,容积会随着温度的改变而改变,故不能盛放过热或者过冷的液体,不能溶解固体和稀释浓溶液,在使用前应查漏,据此分析;
(3)依据m=CVM计算需要溶质的质量;定容时仰视刻度线导致溶液体积偏大,依据C=$\frac{n}{V}$进行误差分析;
(4)依据C=$\frac{1000ρω}{M}$计算质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积,据此选择合适的量筒.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量或者量取、溶解或者稀释、移液、洗涤、定容等,用到的仪器:托盘天平和药匙或者量筒、烧杯、玻璃棒、容量瓶、胶头滴管;配制450mL溶液需要选择500mL容量瓶;
所以用不到的仪器:平底烧瓶和分液漏斗;还缺少的仪器:烧杯、玻璃棒、500mL容量瓶;
故答案为:A、C;烧杯、玻璃棒、500mL容量瓶;
(2)A.容量瓶带有活塞,使用前应检验容量瓶是否漏液,故A正确;
B.容量瓶用水洗净后,再用待配溶液洗涤,导致溶质的物质的量偏大,溶液浓度偏高,故B错误;
C.容量瓶不能用来溶解固体,故C错误;
D.容量瓶不能用来稀释浓溶液,故D错误;
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,故E正确.
故选:BCD;
(3)需要用0.1mol/L NaOH溶液450mL,实际应选择500mL容量瓶,配制500mL溶液,需要氢氧化钠的质量m=0.1mol/L×40g/mol×0.5L=2.0g;
在实验中其他操作均正确,若定容时仰视刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$可知溶液浓度偏小;
故答案为:2.0g;小于;
(4)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积V,依据液稀释过程中溶质的物质的量不变得V×18.4nol/L=0.5mol/L×500mL,解得V=13.6mL,需要选择15mL量筒;
故答案为:13.6;15;
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶的使用方法和注意事项,注意误差分析的方法.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
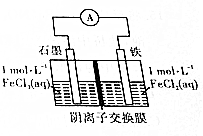
| A. | FeCl3和FeCl2可以互换位置,对反应无影响 | |
| B. | 该电池总反应为FeCl3+Fe═2FeCl2 | |
| C. | 若溶解2.8g铁,约有0.1molCl-从交换膜左向右迁移 | |
| D. | 一段时间后,阴膜左、右侧离子数变化量之比约为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
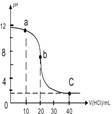
| A. | a点时,溶液呈碱性,溶液中c(B+)>c(Cl-) | |
| B. | b点时溶液的pH=7 | |
| C. | 当c(B+)=c(Cl-)时,v(HCl)<20mL | |
| D. | c点时溶液的c(H+)约为0.03mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加蒸馏水 | B. | 加浓盐酸 | C. | 加AgNO3溶液 | D. | 加氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com