
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00- | 24.00 |
分析 (1)根据碱式滴定管在装液前应用所装液体进行润洗;根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(2)滴定结束前溶液为无色,滴定结束后溶液变为无色,据此判断滴定终点的现象;
(3)先计算出三次滴定消耗标准液体积,然后判断数据的有效性,再根据有效体积计算出消耗标准液的平均体积,然后根据中和反应实质计算出盐酸的浓度.
解答 解:(1)碱式滴定管未用标准盐酸溶液润洗就直接注入标准NaOH溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)•V(标准)}{V(待测)}$可知c(标准)偏大,
故答案为:①;偏大;
(2)盐酸中滴入酚酞,溶液为无色,当恰好反应生成醋酸钠溶液时,溶液呈碱性,则溶液会变为红色,则滴定终点的现象为:无色变为粉红色,半分钟内不变色,
故答案为:无色变为粉红色,半分钟内不变色;
(3)第一次滴定消耗氢氧化钠溶液的体积为:20.40mL-0.40mL=20.00mL;
第二次滴定消耗氢氧化钠溶液的体积为:24.10mL-2.00mL=22.10mL;
第三次滴定消耗氢氧化钠溶液的体积为:24.00mL-4.00mL=20.00mL,
根据计算可知,第二次滴定误差较大,应该舍弃,另外两次滴定消耗标准液的平均体积为20.00mL,
根据c=$\frac{n}{V}$、n(HCl)=n(NaOH)可知,由于两溶液的体积相等,则二者的浓度也相等,
所以该盐酸溶液的浓度为0.20mol/L,
故答案为:0.20.
点评 本题考查中和滴定操作方法,题目难度不大,明确中和滴定操作方法为解答关键,注意掌握中和反应原理及误差分析的方法与技巧,试题培养了学生的分析能力及化学实验能力.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:解答题
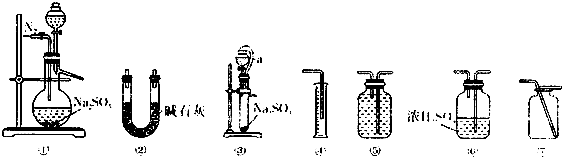
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
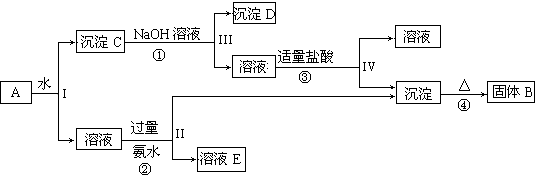
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
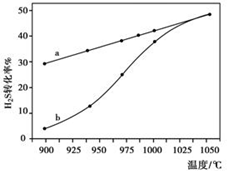 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)?CO(g)+H2(g) K1 II:CO(g)+H2O(g)?CO2(g)+H2(g) K2 III:CaO(s)+CO2(g)?CaCO3(s) K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1 V:CaCO3(s)=CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
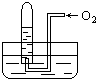 如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )| A. | 肯定是NO2气体 | B. | 肯定是O2与NO2的混合气体 | ||
| C. | 肯定是NO与O2的混合气体 | D. | 可能是NO与NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 在 CuSO4溶液中加入一小块Na | Na溶解,生成沉淀 | 有Cu产生 |
| B | 将浓氨水滴加至烧瓶中的CaO上 | 产生的气体可使湿润的红色石蕊试纸变蓝 | 有氨气生成 |
| C | 在Fe(NO3)2溶液中加入稀H2SO4 | 溶液变为黄色 | 稀H2SO4具有氧化性 |
| D | 将氨气通入I2-淀粉溶液中 | 溶液蓝色褪去 | 氯气具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com