
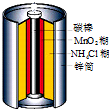
| A. | 电池内部含有电解质 | B. | 锌是负极,碳棒是正极 | ||
| C. | 电子由碳棒经外电路流向锌 | D. | 锌锰干电池属一次电池 |
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
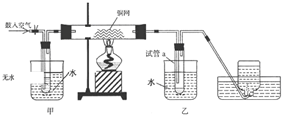
科目:高中化学 来源: 题型:实验题

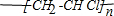
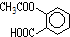 ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在潮湿的空气中生锈是电化学腐蚀 | |
| B. | 用铂电极电解氯化钠溶液时,阳极上铂失去电子溶解,阴极上析出钠- | |
| C. | 二次电池某电极充电时作阳极,放电时作负极 | |
| D. | 原电池中电子由正极流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
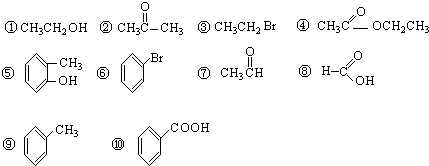
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精清洗沾在皮肤上的少量苯酚 | B. | 用溴水验证汽油中含有不饱和烃 | ||
| C. | 银镜反应后的试管用稀硝酸清洗 | D. | 用分液漏斗分离苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com