



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
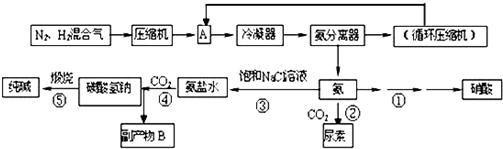
| ���� | ���� | ���� | �� |
| �۵㣨�棩 | -210 | -253 | -78 |
| �е㣨�棩 | -195 | -259 | -33 |
 ��Ӧ�ڵĻ�ѧ����ʽ��
��Ӧ�ڵĻ�ѧ����ʽ��
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ˮ����ʯ����Һ�У�ֻ�ܿ�����Һ��� |
| B��ͭ˿��Cl2��ȼ�պ�����ƿ�м�ˮ����Һ������ɫ��˵��CuCl2������ɫ�� |
| C��������ˮ����ʱ�����ݲ�����������Ϊ���� |
| D������������ȼ�գ�����ʻ�ɫ������ƿ�����ɰ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��A��B��C��Ũ�Ȳ��ٱ仯 |
| B���������������ʵ������ٱ仯 |
| C����λʱ����a mol A���ɣ�ͬʱ����3a mol B |
| D��C������������C�ķֽ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼΪʵ������ȡ����ˮ��װ��ʾ��ͼ������ͼʾ�ش���������
��ͼΪʵ������ȡ����ˮ��װ��ʾ��ͼ������ͼʾ�ش����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����pH=1��Һ�У�NH4+��Fe2+��NO3-��Cl- |
| B������Al�ܷų�H2����Һ�У�Cl-��HCO3-��SO42-��NH4+ |
| C����ˮ�������c��OH-��=1��10-13 mol?L-1����Һ�У�Na+��Ba2+��Cl-��Br- |
| D���н϶�Fe3+����Һ�У�Na+��NH4+��SCN-��HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������56.9 kJ |
| B����56.9 kJ |
| C������56.9 kJ |
| D������ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��x=2 | ||
| B���μӷ�Ӧ��Fe2+ȫ������ԭ�� | ||
| C��ÿ����1mol Fe3O4����Ӧת�Ƶĵ�������Ϊ4mol | ||
D��1mol Fe2+������ʱ����Fe2+��ԭ��O2�����ʵ���Ϊ
|
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com