
 某研究性学习小组根据氧化还原反应规律,欲探究NO2、NO与Na2O2反应的情况.
某研究性学习小组根据氧化还原反应规律,欲探究NO2、NO与Na2O2反应的情况.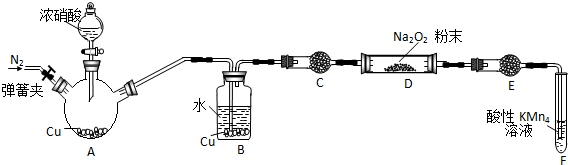
分析 (1)Cu和浓硝酸反应生成硝酸铜、二氧化氮和水;
(2)Cu和浓硝酸的反应是放热反应,放出的热量导致水分蒸发,所以生成的二氧化氮中含有水蒸气,水和过氧化钠反应生成氧气,从而产生干扰;
(3)过氧化钠和二氧化氮反应不生成氧气,说明二氧化氮被过氧化钠氧化,则二氧化氮作还原剂、过氧化钠作氧化剂;
(4)①装置中含有空气,对实验产生干扰;
②为防止水蒸气和过氧化钠反应生成氧气,应该通过C装置除去水蒸气;E是防止F中水蒸气进入D装置;
③二氧化氮和酸性高锰酸钾溶液发生氧化还原反应生成硝酸根离子和锰离子,根据转移电子守恒计算其物质的量;
④亚硝酸钠和稀盐酸反应生成红棕色气体二氧化氮,根据D中固体和稀盐酸混合现象判断成分.
解答 解:(1)①Cu与浓硝酸反应生成二氧化氮、硝酸铜和水,其反应的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)Cu与浓硝酸反应生成二氧化氮中含有水蒸气,水蒸气能与过氧化钠反应生成氧气,从而对实验目的产生干扰,所以要在A、B之间增加一个装置干燥装置,除去生成NO2气体中混有的水蒸气,故答案为:除去生成NO2气体中混有的水蒸气;
(3)过氧化钠和二氧化氮反应不生成氧气,说明二氧化氮被过氧化钠氧化,所以假设2正确,反应方程式为2NO2+Na2O2=2NaNO3,
故答案为:2;2NO2+Na2O2=2NaNO3;
(4)①空气中的氧气能氧化NO,实验时要排尽装置中的空气,所以在反应前,打开弹簧夹,通入一段时间N2,目的是:将装置中的空气排出;
故答案为:将装置中的空气排出;
②防止水蒸气和过氧化钠反应生成氧气,应该通过C装置除去水蒸气;E是防止F中水蒸气进入D装置,所以CF的目的都是作干燥剂,只有无水硫酸铜不能吸收水分,故选A;
③F中为吸收一氧化氮的反应,其氧化剂为高锰酸根被还原生成二价锰离子降低5价,还原剂为NO被氧化成硝酸根升高3价,则根据得失电子守恒氧化剂与还原剂的物质的量之比为3:5,故答案为:3:5;
④亚硝酸钠中加盐酸会生成NO,NO遇到空气中的氧气会变为红棕色,则检验D装置中物质的方法为:取D装置中产物少许,加入稀盐酸,若产生无色气体,遇到空气变为红棕色,产物是亚硝酸钠;
故答案为:加入稀盐酸,产生红棕色气体.
点评 本题考查性质实验方案评价,为高频考点,涉及物质检验、基本操作、氧化还原反应等知识点,明确实验目的、物质性质等知识点是解本题关键,注意结合题给信息解答解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol碳正离子(CH3+)所含的电子总数为8NA | |
| B. | 1mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有碳碳双键数为NA | |
| D. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NN |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 298 | 块状 | 2.00 |
| ② | |||
| ③ | 308 | 块状 | 2.00 |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KW是常温时的10-2倍 | B. | 温度不变冲稀10倍,pH=7 | ||
| C. | pH=6显弱酸性 | D. | c(H+)=10-6mol/L,溶液为中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量红色粉末于试管中,并加入过量3mol•L-1 稀H2SO4,充分反应后,将上层清液分成两份 | (1)若有红色固体剩余,则假设2,3可能成立; (2)若无红色固体剩余,则假设1,3可能成立 |
| 若步骤1中有红色固体剩余; 步骤2:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液仍为蓝色,则假设2成立; |
| 若步骤1中有红色固体剩余; 步骤3:取步骤1充分反应后的上层清液于试管中,加入足量3%的H2O2 溶液,再加入几滴20%的KSCN溶液 | 若溶液变为血红色,则假设3成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S | D. | 气态氢化物稳定性:HCl>H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com