
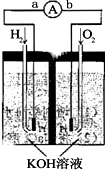
 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.
| ||
| ||


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、Na+、K+、HCO3-、NO3- |
| B、Na+、K+、Cl-、MnO4- |
| C、NH4+、K+、SO42-、NO3- |
| D、Na+、Fe2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、碳酸氢钠溶液与过量石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| C、硝酸铝溶液中加过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| D、向次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 436.0kJ?mol-1 |
| 945.8kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢化物的稳定性:HnX>HnW,是因为HnX 分子间存在氢键 |
| B、原子序数:W>Y>Z>X |
| C、离子的还原性:X>W |
| D、原子半径:Y>Z>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com