
| A. | 肯定有Al3+、Mg2+、NH4+、SO32-、Br | B. | 肯定有Mg2+、Br-、HCO3-、SO42- | ||
| C. | 肯定无Ag+、Cl-、I-、AlO2-、MnO4 | D. | 可能有K+、Cl-、SO42-、I- |
分析 无色溶液中一定不存在有色的MnO4-,
①取少量原溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,原溶液中可能含有Ag+、Al3+、Mg2+,则一定不存在SO32-、AlO2-;再加热,未见有气体放出,则一定不存在NH4+;
②重新取少量原溶液,滴加适量的饱和氯水,有气泡生成,溶液呈现橙黄色;加入四氯化碳振荡、静置,四氯化碳层呈橙红色;则原溶液中一定含有HCO3-、Br-,一定不含Ag+、I-;分液后,向水层加入BaCl2溶液,有白色沉淀产生,该白色沉淀只能为硫酸钡,则原溶液中一定存在SO42-,据此对各选项进行判断.
解答 解:无色溶液中一定不存在有色的MnO4-,
①取少量原溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,原溶液中可能含有Ag+、Al3+、Mg2+,则一定不存在SO32-、AlO2-;再加热,未见有气体放出,则一定不存在NH4+;
②重新取少量原溶液,滴加适量的饱和氯水,有气泡生成,溶液呈现橙黄色;加入四氯化碳振荡、静置,四氯化碳层呈橙红色;则原溶液中一定含有HCO3-、Br-,一定不含Ag+、I-;分液后,向水层加入BaCl2溶液,有白色沉淀产生,该白色沉淀只能为硫酸钡,则原溶液中一定存在SO42-,
根据分析可知,原溶液中一定存在的离子为:Mg2+、Br-、HCO3-、SO42-;一定不存在的离子为:SO32-、NH4+、Ag+、I-、AlO2-、MnO4-;可能存在的离子为:Al3+、K+、Cl-,
A.一定不含NH4+、SO32-,可能含有Al3+,故A错误;
B.原溶液中一定存在的离子为:Mg2+、Br-、HCO3-、SO42-,故B正确;
C.原溶液中可能含有Cl-,故C错误;
D.原溶液中一定不含I-,一定含有SO42-,故D错误;
故选B.
点评 本题考查了阴阳离子的检验,题目难度中等,明确常见离子的性质及发生的反应为解答关键,注意熟练掌握常见离子的检验方法,试题侧重考查学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
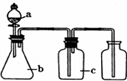 如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( )
如图各相应一起中加入的试剂,可用于制取、净化、收集的气体是( ) | 选项 | 气体 | a | b | c |
| A | H2 | 稀硫酸 | 锌粒 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | 高锰酸钾 | 浓硫酸 |
| C | C2H2 | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | O2 | 过氧化氢溶液 | 二氧化锰 | 碱石灰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的NH4Cl和NH3•H2O的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在A溶剂中,甲的酸性大于乙;在B溶剂中,甲的酸性可能小于乙 | |
| B. | HNO3在HClO4中是酸,在H2SO4中可能是碱 | |
| C. | 比较HCl,H2SO4,HClO4,HNO3酸性的强弱,用水肯定不能,用冰醋酸可能可以 | |
| D. | 比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
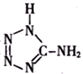 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象 | |
| B. | 取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象 | |
| C. | 取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化 | |
| D. | 取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CH3COO- | ||
| C. | Na+、NH4+、NO3-、S2- | D. | Na+、Ag+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 指定环境 | 能够共存的离子 |
| A | 滴加酚酞显红色的溶液 | K+、S2-、SO42-、NO3- |
| B | 有HCO3-存在的溶液 | Na+、K+、C1-、A13+ |
| C | pH=1的溶液中 | C1-、CO32-、NO3-、NH4+ |
| D | 使石蕊变红的溶液中 | Fe2+、MnO4-、NO3-、SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com