
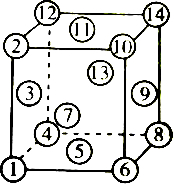
| A. | ④⑤⑥⑩⑪⑫ | B. | ②③④⑤⑥⑦ | C. | ①④⑤⑥⑧ | D. | ①②⑪⑭⑧⑤ |
分析 面心立方晶胞的对角线是垂直于密置层面的直线,所以要找处于同一层上的原子,必须找出垂直于体对角线的面,结合图象分析.
解答 解:面心立方最密堆积:将第一密置层记作A,第二层记作B,B层的球对准A层中顶点向上(或向下)的三角形空隙位置;第三层记作C,C层的球对准B层的空隙,同时应对准A层中顶点向下(或向上)的三角形空隙(即C层球不对准A层球).以后各层分别重复A、B、C等,这种排列方式三层为一周期,记作…ABCABC…,如下图 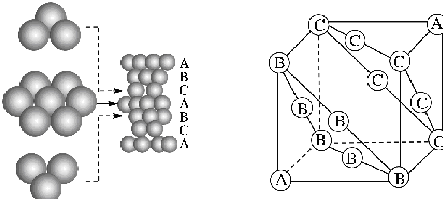
.
由于在这种排列中可以划出面心立方晶胞,故称这种堆积方式为面心立方最密堆积;
故题中对应的六个B是2,3,4,5,6,7.当然也可以是8,9,10,11,12,13,或者是4,5,6,9,13,14,或者是1,5,7,8,9,10等,故B正确;
故选B.
点评 本题考查了金属晶体的堆积方式,题目难度中等,注意根据面心立方最密堆积的堆积原理分析.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:填空题
 .
.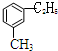 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$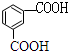
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛与银氨溶液水浴共热,发生还原反应得到光亮如镜的银 | |
| B. | 苯乙烯与氢气在合适条件下,发生加成反应生成乙基环己烷 | |
| C. | 乙醇与浓硫酸共热迅速升温至140℃时,发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下,发生取代反应主要生成2,4二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
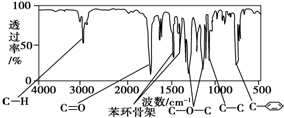 化合物A经李比希法测得其 中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.
化合物A经李比希法测得其 中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.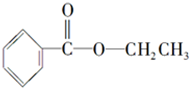 、
、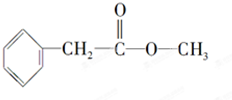 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26Fe的价层电子排布式为3d64s2 | |
| B. | 35Br的电子排布式可简写为[Ar]4s24p5 | |
| C. | NH4Cl的电子式为  | |
| D. | 氯离子结构示意图为 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中含有的NH4+数目小于NA | |
| B. | 24g石墨烯(单层石墨)中含有六元环的个数为NA | |
| C. | 标准状况下,6.72LNO2与足量水反应转移电子数目为0.2NA | |
| D. | 4.6gC2H6O加入足量的金属钠,充分作用,生成H2分子数一定为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为a kJ•mol-1 | B. | a一定大于0 | ||
| C. | a+b=-638.5 | D. | b一定小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
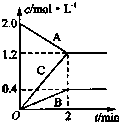 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com