
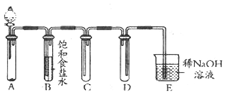
 如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.
如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.分析 实验室用高锰酸钾和浓盐酸反应制备氯气,发生反应2KMnO4+16HCI(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,A为气体的发生装置,B用于除去氯化氢,C为气体的收集装置,D为防倒吸装置,E为尾气处理装置,以此解答该题.
解答 解:(1)由以上分析可知D为防倒吸装置,防止E中的液体倒吸进入C中,故答案为:防止E中的液体倒吸进入C中;
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O.
点评 本题主要考查氯气的制备,为高频考点,侧重考查学生的分析、实验能力,题目难度中等,本题注意把握实验原理结合物质的性质判断装置的选择.


科目:高中化学 来源: 题型:填空题
 中的※C原子为手性碳原子;若一个碳原子上连着2个C=C(如
中的※C原子为手性碳原子;若一个碳原子上连着2个C=C(如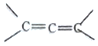 )时,极不稳定,不存在.现有某链烃C7H10的众多同分异构体中:
)时,极不稳定,不存在.现有某链烃C7H10的众多同分异构体中: ═CH-CH3
═CH-CH3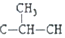 ═CH2
═CH2 -CH≡CH3
-CH≡CH3 ;
; .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某溶液中加入BaCl2溶液,再加入盐酸 | 证明溶液中是否含SO42- |
| B | 加热铝箔,熔化的铝不滴落 | 铝表面的氧化膜熔点高,包在熔化的铝外面 |
| C | Cl2能使湿润的紫色石蕊试纸先变红后褪色 | Cl2具有漂白性 |
| D | 将SO2通入品红溶液中,品红溶液褪色,加热褪色后的品红溶液,溶液恢复红色 | 验证亚硫酸的不稳定性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
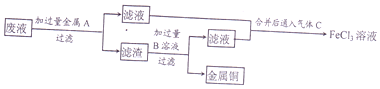
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | 硝酸 | C. | 酒精 | D. | 醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.35mol•L-1•min-1 | B. | v(B)=0.01mol•L-1•s-1 | ||
| C. | v(C)=0.40mol•L-1•min-1 | D. | v(D)=0.45mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
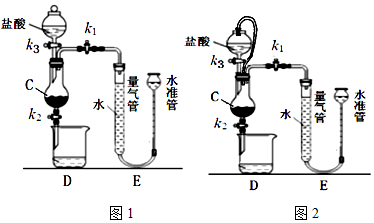
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com