
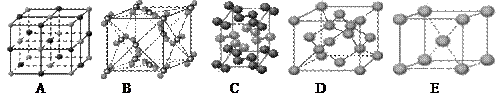
 表示,阴离子B以
表示,阴离子B以 表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;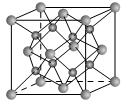
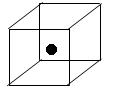
| 化学键 | Si—Cl | H—H | H—Cl | Si—Si |
| 键能/kJ·mol—1 | 360 | 436 | 431 | 176 |
科目:高中化学 来源:不详 题型:填空题
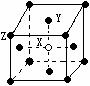
| 原子序数 | 原子价层电子排布 | 周期 | 族 |
| 17 | ① | 第三 | ② |
| ③ | 3d54s1 | ④ | ⅥB |
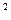 2s
2s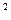 2p
2p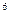 3s
3s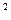 3p
3p 4s
4s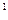 ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 。
,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KCl、 H2SO4、S | B.金刚石、NH4Cl、CH4 |
| C.HF、 SiO2、 Al | D.金刚石、SiO2、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
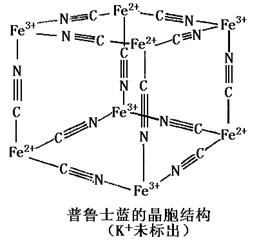
 要的用途。
要的用途。 ,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。 ____ 。
____ 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.晶体Si < 金刚石 | B.CO2 < SiO2 | C. NaCl < NaBr | D. PH3 < NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
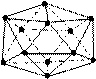
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 s2np2,且X原子半径小于Q;②Y元素是地壳中含量最多的元素;W元素的电负性路小于Y元素,在W原子的价电子排布式中,p轨道上只有1个未成对电子;③Z元素的电离能数据见下表(kJ·mol-1)
s2np2,且X原子半径小于Q;②Y元素是地壳中含量最多的元素;W元素的电负性路小于Y元素,在W原子的价电子排布式中,p轨道上只有1个未成对电子;③Z元素的电离能数据见下表(kJ·mol-1)| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
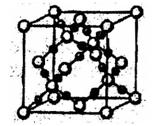
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
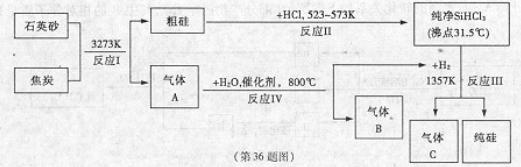
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com