
【题目】加热条件下,20 mL 18 mol/L的浓H2SO4与过量的碳反应,可得到标况下的CO2
A. 小于4.032L B. 等于4.032L C. 大于4.032L D. 无法确定
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2 NCOONH4)是一种白色晶体,是常见的实验药品,可由干燥的NH3和干燥的CO2在任何比例下反应得到每生成1.0g氨基甲酸铵放出2.05kJ的热量。回答下列问题:
(1)实验室可选用下列装置(I~V)制备干燥的NH3和CO2。
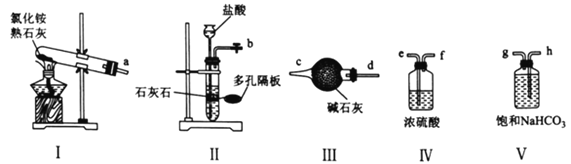
①用装置I、Ⅲ制备并纯化NH3时,接口a与________________(填接口字母)相连,装置I中发生反应的化学方程式为________________________。
②制备并纯化CO2时,按气流从左至右的方向,各接口连接顺序为________________(填接口字母)
(2)一种制备氨基甲酸铵的改进实验装置如下图所示:

①用仪器W代替分液漏斗的优点是________________________;用干冰装置代替(1)中制备并纯化CO2装置的优点是________________________。
②“薄膜反应器”中发生反应的热化学方程式为________________________;盛浓硫酸的装置的作用是________________________________(列举2点)。
③体系中若有水蒸气,还可能生成的铵盐是________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________, 仪器 B________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________。
③下列有关步骤Y的说法,正确的是________。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________。
(3)方案甲中采用蒸馏不合理,理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸乙酯,反应温度为115~125℃,反应装置如图。下列对该实验的描述错误的是

A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 提纯乙酸乙酯需要经过水、氢氧化钠溶液洗涤
D. 加入过量乙酸可以提高乙醇的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月10日,受超强台风“利奇马”影响沿海多地发生泥石流灾害,造成重大损失,防疫部门对受灾地区开展消毒防疫工作。下列消毒使用的药品中属于电解质的是( )
A.漂白水B.碘水C.84消毒液D.高锰酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学键键能数据如下:
化学键 | H—H | Cl—Cl | H—Cl |
键能kJ/mol | 436 | 243 | 431 |
则下列热化学方程式不正确( )
A. ![]() H2(g)+
H2(g)+![]() Cl2(g)=HC(g) △H=-91.5kJ/mol
Cl2(g)=HC(g) △H=-91.5kJ/mol
B. H2(g)+ Cl2(g)=2HCl(g) △H=-183kJ/mol
C. ![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) △H=+91.5kJ/mol
Cl2(g)=HCl(g) △H=+91.5kJ/mol
D. 2HCl(g)=H2(g)+Cl2(g) △H=+183kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,电源为Zn-MnO2干电池,其电解质溶液是ZnCl2-NH4Cl混合溶液。X、Y都是惰性电极。将电源接通后,向甲中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题:

(1)在电源中,B电极为________极(填“正极”或“负极”);该极的电极反应是____________。
(2)甲装置中总的化学方程式是______________________________________________。
(3)丙装置在通电一段时间后,X电极上发生的电极反应式是________________________。
(4)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为___L。
(5)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com