

| A. | 高温煅烧石灰石 | |
| B. | 氧化钙与水反应 | |
| C. | 氢气还原氧化铜 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl固体的反应 |
分析 由图可知反应物总能量大于生成物总能量,则为放热反应,
①放热反应:有热量放出的化学反应,因为反应物具有的总能量高于生成物具有的总能量.常见放热反应:燃烧与缓慢氧化,中和反应;金属与酸反应制取氢气,生石灰和水反应等.
②吸热反应:有热量吸收的化学反应,因为反应物具有的总能量低于生成物具有的总能量.常见的吸热反应:C(s)+H2O(g)→CO(g)+H2O; C+CO2→CO的反应,以及KClO3、KMnO4、CaCO3的分解等,以此解答该题.
解答 解:A.高温煅烧石灰石,为吸热反应,故A不选;
B.氧化钙与水反应放出大量的热,为放热反应,故B选;
C.氢气还原氧化铜为吸热反应,故C不选;
D.Ba(OH)2•8H2O晶体与NH4Cl固体的反应为吸热反应,故D不选.
故选B.
点评 本题考查化学反应的热量变化,为高频考点,侧重考查学生的双基知识,难度不大,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b中铝元素是以阳离子形式存在 | |
| B. | ①、②中除加试剂外,还需要进行过滤操作 | |
| C. | ④进行的操作是加热,而且d一定是氧化铝 | |
| D. | ③中需要通入过量的二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
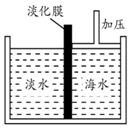 海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.
海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.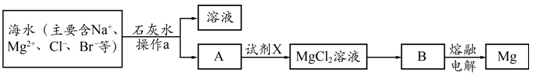
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在t℃时,Ag2CrO4(橘红色) 在水溶液中沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色) 在水溶液中沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )| A. | 将AgNO3溶液滴加到KCl溶液中,反应的活化能几乎为零 | |
| B. | t℃时,Ag2CrO4的Ksp=1×10-8 | |
| C. | 饱和Ag2CrO4溶液中,加入水能使溶液由X点变为Y点 | |
| D. | t℃时,AgCl比Ag2CrO4的溶解度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到反应限度时SO2的消耗速率必定等于O2的生成速率 | |
| B. | 达到反应限度时,反应放出197kJ 的热量 | |
| C. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| D. | SO2和SO3物质的量之和一定为2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com