
| A.加入少量W,逆反应速率增大 |
| B.当v正(X)=2v逆(Z)时,反应达到平衡 |
| C.升高温度,平衡逆向移动 |
| D.平衡后加入X,再次达到平衡后X的体积分数减少 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.①③④⑤ | B.②③⑥ | C.③④⑤⑥ | D.②④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用物质A表示2s内的平均反应速率为0.3mol/(L?s) |
| B.用物质B表示2 s内的平均反应速率为0.6mol/(L?s) |
| C.2s后物质A的转化率为70% |
| D.2s后物质B的浓度为0.35mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
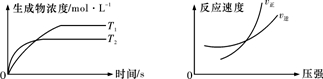
| A.a+b>c+d T1>T2 △H>0 | B.a+b>c+d T1<T2 △H<0 |
| C.a+b<c+d T1>T2 △H>0 | D.a+b<c+d T1<T2 △H<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同时进行时,情况1的反应速率(SO2)比情况2的大 |
| B.平衡时,情况1:Q=393.2kJ |
| C.达到平衡时,混合气体的密度,情况1比情况2大 |
| D.平衡时,情况2:Q<196.6kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.图1表示恒温恒压下条件,向2HI  H2 + I2 ΔH>0的反应达到平衡的容器中充入HI,甲表示正反应速率,乙表示逆反应速率 H2 + I2 ΔH>0的反应达到平衡的容器中充入HI,甲表示正反应速率,乙表示逆反应速率 |
B.图1表示恒容下条件,向2HI  H2 + I2 ΔH>0的 反应达到平衡的容器加热,甲表示正反应速率,乙表示逆反应速率 H2 + I2 ΔH>0的 反应达到平衡的容器加热,甲表示正反应速率,乙表示逆反应速率 |
C.图2表示恒温条件下,压缩2SO3(g) 2SO2(g)+O2(g) ΔH>0平衡反应体系,甲表示的SO3物质的量的变化,乙表示的SO3物质的量浓度的变化 2SO2(g)+O2(g) ΔH>0平衡反应体系,甲表示的SO3物质的量的变化,乙表示的SO3物质的量浓度的变化 |
D.图2表示恒容条件下,对于2SO3(g) 2SO2(g)+O2(g) ΔH>0反应平衡体系,甲表示升高温度SO3物质的量的变化,乙表示增加O2后SO3物质的量变化 2SO2(g)+O2(g) ΔH>0反应平衡体系,甲表示升高温度SO3物质的量的变化,乙表示增加O2后SO3物质的量变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表: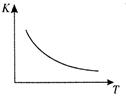

| A.单位时间内减少 CO(g)的浓度等于生成 CO2 (g)的浓度 |
| B.反应容器内的压强不发生变化 |
| C.混合气体中 H2 (g)的浓度不再发生改变 |
| D.氢气的生成速率等于水的生成速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com