
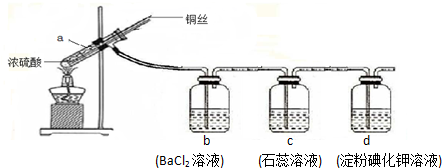
| A. | a装置中有白色固体 | B. | b装置中产生白色沉淀 | ||
| C. | c装置中溶液先变红后褪色 | D. | d装置中溶液变蓝色 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醇和浓硫酸制乙烯 | B. | 用电解水获得的氢气来合成氨 | ||
| C. | 用晒盐后的卤水制溴单质 | D. | 用氢氧化钠和二氧化碳制碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验过程中水的电离程度的变化是先增大后减小 | |
| B. | 当溶液呈中性时,反应恰好完全 | |
| C. | 当反应恰好完全时,消耗NaOH溶液10mL | |
| D. | 当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 11.2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| C. | 300ml2mol•L-1蔗糖溶液中所含分子数为0.6NA | |
| D. | 标准状况下,30g乙酸和甲醛的混合物中氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
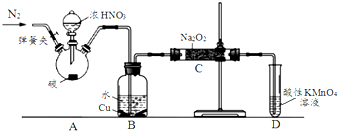
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
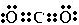 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com