
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂. ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素,则A为H元素;
B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B为C元素;
D原子的核外成对电子数是未成对电子数的3倍,则D是O元素,C原子序数大于B而小于D,则C为N元素;
E有“生物金属”之称,E4+和氩原子的核外电子排布相同,则E为Ti元素,
A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M为HCHO;
A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,则N是苯,
(1)H2O2分子中H-O、O-O原子之间都共用一对电子;E是Ti元素,其3d、4s电子为其外围电子,根据构造原理书写其外围电子排布式;
(2)B、C、D分别是C、N、O元素,同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素;
(3)单质B是碳、C的最高价氧化物的水化物的浓溶液是硝酸,在加热条件下C和浓硝酸发生氧化还原反应生成二氧化碳、二氧化硫和水;
(4)a. M是双氧水、N是苯,双氧水是极性分子,苯是非极性分子;
b. 双氧水中每个O原子价层电子对个数是4,CO2分子中C原子价层电子对个数是2;
c. 苯分子中含有1个大π键和12个σ键;
d. 原子晶体熔沸点高于分子晶体;
(5)根据盖斯定律计算反应热;
(6)①该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小;
②先计算浓度商,如果浓度商大于平衡常数,则平衡逆向移动,如果浓度商等于平衡常数,则平衡不移动;如果浓度商小于平衡常数,则平衡正向移动.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素,则A为H元素;
B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B为C元素;
D原子的核外成对电子数是未成对电子数的3倍,则D是O元素,C原子序数大于B而小于D,则C为N元素;
E有“生物金属”之称,E4+和氩原子的核外电子排布相同,则E为Ti元素,
A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M为HCHO;
A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,则N是苯,
(1)H2O2分子中H-O、O-O原子之间都共用一对电子,其电子式为 ;E是Ti元素,其3d、4s电子为其外围电子,根据构造原理书写其外围电子排布式为3d24s2,
;E是Ti元素,其3d、4s电子为其外围电子,根据构造原理书写其外围电子排布式为3d24s2,
故答案为: ;3d24s2;
;3d24s2;
(2)B、C、D分别是C、N、O元素,同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,其第一电离能从小到大顺序是C<O<N,故答案为:C<O<N;
(3)单质B是碳、C的最高价氧化物的水化物的浓溶液是硝酸,在加热条件下C和浓硝酸发生氧化还原反应生成二氧化碳、二氧化硫和水,反应方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)a. M是双氧水、N是苯,双氧水分子是书页形分子,是极性分子,苯分子中所有原子共平面,是非极性分子,故正确;
b. 双氧水中每个O原子价层电子对个数是4,CO2分子中C原子价层电子对个数是2,双氧水分子中O原子采用sp3杂化,二氧化碳分子中C原子采用sp杂化,故错误;
c. 苯分子中含有1个大π键和12个σ键,故错误;
d. 原子晶体熔沸点高于分子晶体,二氧化碳是分子晶体、二氧化硅是原子晶体,所有二氧化碳晶体熔沸点小于二氧化硅,故正确;
故选ad;
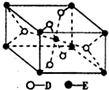
(5)①E的一种氧化物Q,该晶胞中Ti原子个数=1+8×$\frac{1}{8}$=2,O原子个数=2+4×$\frac{1}{2}$=4,所以其化学式为TiO2;
①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+140kJ/mol
②2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
将方程式①+②得TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol,
故答案为:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol;
(6)①该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,所以K1>K2,
故答案为:>;
②先计算浓度商,如果浓度商大于平衡常数,则平衡逆向移动,如果浓度商等于平衡常数,则平衡不移动;如果浓度商小于平衡常数,则平衡正向移动,NH3和N2、H2的物质的量浓度分别为:3mol÷0.5L=6mol/L、1mol÷0.5L=2mol/L、2mol÷0.5L=4mol/L,浓度商=$\frac{{6}^{2}}{2×{4}^{3}}$=0.28<0.5,则平衡正向移动,化学反应速率V(C2)正>(C2)逆,故答案为:>.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、化学平衡有关计算、盖斯定律、原子杂化方式判断、原子核外电子排布等知识点,明确物质结构、原子结构、基本理论是解本题关键,难点是有关平衡常数计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S在纯氧中燃烧可生成SO3 | |
| B. | 用澄清石灰水可鉴别CO2和SO2 | |
| C. | SO2能使KMnO4溶液褪色 | |
| D. | CO2通入CaCl2溶液中能产生白色沉淀考点:考查S、SO2、CO2的性质以及鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与W形成的化合物均与BaCl2溶液反应产生沉淀 | |
| B. | Z、W的简单离子均可促进水的电离 | |
| C. | 原子半径:X<Y<Z<W | |
| D. | X与Y形成的化合物中均只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 实验目的或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
| B | 将某气体通入品红溶液,溶液褪色 | 检验气体中的SO2 |
| C | 测定等物质的量浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH)和Ka2(H2S)的大小 |
| D | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4溶液和KMnO4溶液,观察气体产生的速度 | 比较CuSO4和KMnO4的催化效果 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是222 | |
| B. | Se是人体必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析,${\;}_{6}^{13}$C的中子数为6 | |
| D. | 原子结构示意图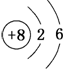 既可以表示16O,也可以表示18O 既可以表示16O,也可以表示18O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能使酸性高锰酸钾溶液褪色 | B. | 可以用排水法或向下排空气法收集 | ||
| C. | 是最简单的有机物 | D. | 能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com