
(双选)往一个体积不变的密闭容器中充入H2和I2发生反应H2(g)+I2(g) 2HI(g) △H>0,当达到平衡后,t0时改变某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是( )
2HI(g) △H>0,当达到平衡后,t0时改变某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是( )
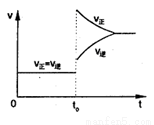
A.容器内气体颜色变浅,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2的转化率增大,HI平衡浓度变小
D.改变条件前后,速率图象如图
科目:高中化学 来源:2016-2017学年河北省高二上学期9月调研化学试卷(解析版) 题型:填空题
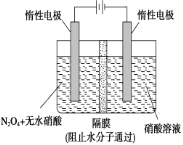
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将________(填“增大”、“减小”或“不变”)。
②下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1 000 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500 s内N2O5的分解速率为__________。
③在T2温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2________T1。
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的________区生成,其电极反应式为______________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:选择题
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始V A =V B =aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X (g) +Y (g)  2Z (g) +W (g) △H>0。达到平衡时,V A =1.2aL,则下列说法错误的是:
2Z (g) +W (g) △H>0。达到平衡时,V A =1.2aL,则下列说法错误的是:

A.反应开始时,B容器中化学反应速率快
B.平衡时,A容器中X的转化率为40%,且比B容器中X的转化率大
C.打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
D.打开K达新平衡后,升高温度,A容器体积一定增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:填空题
高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+ CO(g)  2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=__________,△H______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= _____________、CO的平衡转化率= _____________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A减少Fe的量 B增加Fe2O3的量 C移出部分CO2
D提高反应温度 E减小容器的容积 F加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
(双选)向某密闭容器中加入0 .3 molA 、0 .1 molC 和一定量的 B 三种气体。一定条 件下发生反应,各物质浓度随时间变化如甲图所示[t0~ t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3~t4阶段为使用催化剂。下列说法正确的是 ( )
件下发生反应,各物质浓度随时间变化如甲图所示[t0~ t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3~t4阶段为使用催化剂。下列说法正确的是 ( )
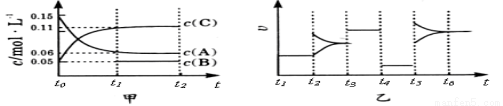
A.若t1=15 s,生成物C在t0~t1时间段的平均反应速率为0.004mol·L-1·s-1
B.t4~t5阶段改变的条件为降低反应温度
C.B的起始物质的量为 0.02mol
D.t5~t6阶段容器内A的物质的量减少0.03 mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g) B(g)+2C(g) ΔH=+100akJ·mol-1
B(g)+2C(g) ΔH=+100akJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上9.4周考化学卷(解析版) 题型:填空题
军事上的“地表伪装”是使军事保护的外观色彩、红外反射与环境吻合。BASF是在20世纪70年代开发的系新型红外伪装还原染料,该染料为橄榄色或黑色。其化学结构为:

请完成下列问题:
(1)染料BASF的分子式可表示为C2n+24HxN2O6,则x=___________。
(2)1mol该物质与Na反应产生氢气的量及在催化剂作用下加成所需氢气的量,其最大值(物质的量)分别为_____________、____________。
(3)当n=3时,其中碳原子上的一氯取代物可能有__________种。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上9.4周考化学卷(解析版) 题型:选择题
己知0.lmol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
A.加少量CH3COONH4固体 B.降低温度
C.加少量NaCl固体 D.升高温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上入学考试化学试卷(解析版) 题型:填空题
(1)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应。
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3 与 ΔH1、ΔH2 之间的关系是:ΔH3=________。
(2)白磷与氧气反应生成P4O10 固体 。下表所示是部分化学键的键能参数:
化学键 | P—P | P—O | P===O | O===O |
键能/kJ·mol-1 | a | b | c | d |
根据右图的分子结构和有关数据通过计算写出该反应的热化学方程式为 。
(3)三聚磷酸可视为三个磷酸分子(磷酸结构式如右下图)之间脱去两个水分子产物,其结构式为_________________,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。


(4)已知298 K时白磷不完全燃烧的热化学方程式为:
P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1 638 kJ·mol-1。
在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一入学考试化学卷(解析版) 题型:选择题
几种物质的化学式及其名称分别是:Na2S2O3硫代硫酸钠;CaSx多硫化钙;BaO2过氧化钡。根据上述命名规律K2CS3的名称应为( )
A.三硫代碳酸钾 B.多硫碳化钙肥 C.过硫碳酸钾 D.超硫碳酸钾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com