
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答:
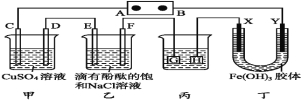
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应是 ,电镀液是 溶液。
【答案】(1)负极 变浅 Fe(OH)3胶粒(2)1∶2∶2∶2(3)铜件 AgNO3
【解析】
试题分析:将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极;
(1)B电极是电源的负极,在A池中,电解硫酸铜的过程中,铜离子逐渐减少,导致溶液颜色变浅,Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷。
(2)C、D、E、F电极发生的电极反应分别为:4OH-═O2↑+2H2O+4e-、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-、2H++2e-═H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2。
(3)丙装置给铜件镀银,则H应是阴极故为铜件,电镀液是硝酸银溶液。


科目:高中化学 来源: 题型:
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即含C元素0.03%~2.0%铁合金)进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____。
(2)取碳素钢6.0 g于15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+外还可能有Fe2+。若要确认其中的Fe2+,应选用____。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液C.浓氨水D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为________。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.089 3 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。
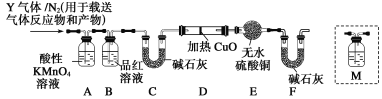
(3)装置B中试剂的作用是________________________。
(4)分析Y气体中的Q2气体是如何生成的______________(用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于________(填序号)。
A.A之前 B.A—B间 C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系![]() ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为 ;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为 ;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟
用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:
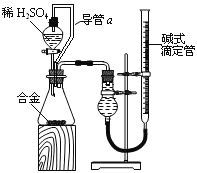
①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和 ;
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=_____L·moL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质] 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用。
(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中1/3的Cu以罕见的Cu3+形式存在。Cu在元素周期表中的位置为____ ,基态Cu3+的核外电子排布式为_ _______。
(2)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合作录音磁带磁粉原料的为____(填选项字母)。
A.V2O5 | B.CrO2 | C.PbO | D.ZnO |
(3)屠呦呦因在抗疟药——青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人。青蒿素的结构简式如图l所示,其组成元素的电负性由大到小的顺序为 ;碳原子的杂化方式有____ 。
(4)“可燃冰”因储量大、污染小被视为未来石油的替代能源,由甲烷和水形成的“可燃冰”结构如图2所示。
①“可燃冰”中分子间存在的2种作用力为 。
②H2O的VSEPR模型为 ,比较键角的大小:H2O CH4(填“>”“<”或“=”),原因为 。
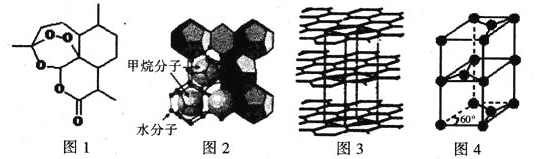
(5)锂离子电池在便携式电子设备以及电动汽车、卫星等领域显示出广阔的应用前景,该电池负极材料为石墨,石墨为层状结构(如图3),其晶胞结构如图4所示,该晶胞中有 个碳原子。已知石墨的层间距为apm,C-C键长为b pm,阿伏伽德罗常数的值为NA,则石墨晶体的密度为 g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳的氧化物直接合成乙醇燃料已进入大规模生产。
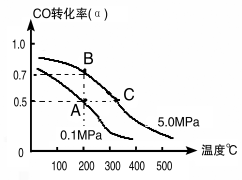
(1)如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
已知:2CO(g)+O2(g)===2CO2(g) △H1=-566kJ·mol-1
2H2(g)+O2(g)===2H2O(l) △H2=-572kJ·mol-1
CH3CH2OH(g)+3O2(g)===2CO2(g)+ 3H2O(g) △H3=-1366kJ·mol-1
H2O(g)===H2O(l) △H4=-44kJ·mol-1
①△H= kJ·mol-1
②若A、C两点都表示达到的平衡状态,则从反应开始到达平衡状态所需的时间tA tC(填“﹥”、“﹤”或“﹦”)。
③若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
④熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极上CO反应的电极反应式为 。
(2)工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: 。
(3)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。

①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)将标准状况下4.48L CO2通入1L 0.3mol·L-1 NaOH溶液中完全反应,所得溶液中微粒浓度关系正确的是
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
C.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途。

(1)写出Se的基态原子的外围电子排布式 。
(2)酒石酸钛配合物广泛应用于药物合成。酒石酸(结构如下图所示)中羧基氧原子的轨道杂化类型分别是 ,1 mol酒石酸中π键的数目是 。
(3)TiCl4熔点是—25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于 晶体;
NO3-离子的空间构型为 。
(4)主族元素A和钛同周期,具有相同的最外层电子数,元素B原子的p能级所含电子总数与s能级所含电子总数相等,且其形成的氢化物分子之间存在氢键。元素A、元素B和钛三者形成的晶体的晶胞如图所示,写出该晶体的化学式 (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述错误的是
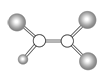
A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有碳碳双键
C.该有机物可以由乙烯和氯化氢加成反应得到
D.该有机物分子中的所有原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和氨气在常温下混合即可发生反应。某兴趣小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如下装置:
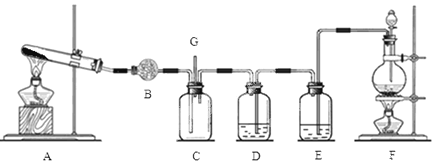
(1)装置F中发生反应的离子方程式是 ;
(2)装置B中盛放的是 ,其作用是 ;装置E中盛放的试剂是 ,其作用是 ;
(3)装置A中发生反应的化学方程式为: ;
(4)若有10.7gNH4Cl,最多可制取标准状况下的氨气的体积是 L;
(5)装置C中有白烟产生,试写出该反应的化学方程式
(6)G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的存储是其应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2![]() 2NH3实现储氢和输氢。下列说法正确的是( )
2NH3实现储氢和输氢。下列说法正确的是( )
A.NH3分子中氮原子的轨道杂化方式为sp2杂化
B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体
C.相同压强下,NH3沸点比PH3的沸点高
D.[Cu(NH3)4]2+中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com